
 Christian Friedrich Schönbein (1799-1868) était un chimiste germano-suisse surtout connu pour avoir inventé la pile à combustible (1838) en même temps que William Robert Grove et ses découvertes du guncotton et de l’ozone.
Christian Friedrich Schönbein (1799-1868) était un chimiste germano-suisse surtout connu pour avoir inventé la pile à combustible (1838) en même temps que William Robert Grove et ses découvertes du guncotton et de l’ozone. 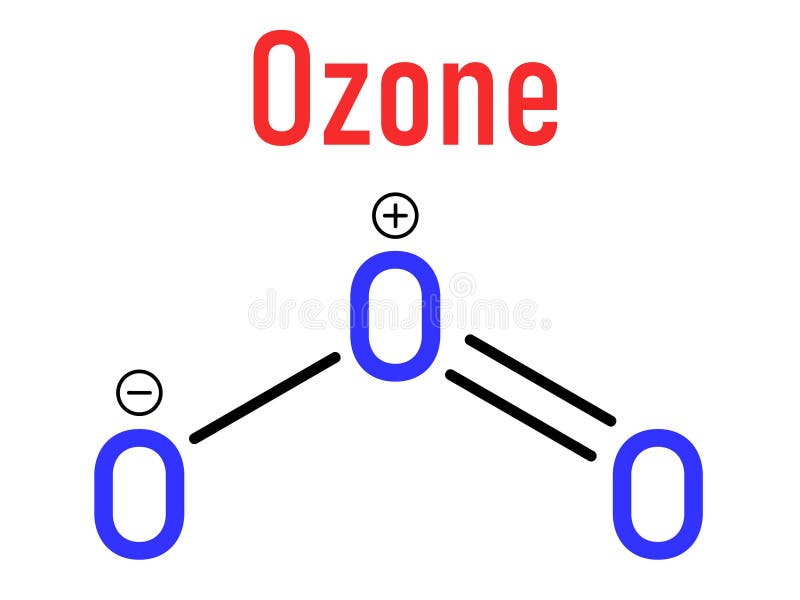 C’est en faisant des expériences sur l’électrolyse de l’eau à l’Université de Bâle que Schönbein a commencé à remarquer une odeur particulière dans son laboratoire. Cette odeur a donné à Schönbein l’indice de la présence d’un nouveau produit issu de ses expériences. En raison de l’odeur prononcée, Schönbein a inventé le terme « ozone » pour le nouveau gaz, du mot grec « ozein », qui signifie « sentir ». En 1839, Schönbein publie le principe de la pile à combustible dans le « Philosophical Magazine ».
C’est en faisant des expériences sur l’électrolyse de l’eau à l’Université de Bâle que Schönbein a commencé à remarquer une odeur particulière dans son laboratoire. Cette odeur a donné à Schönbein l’indice de la présence d’un nouveau produit issu de ses expériences. En raison de l’odeur prononcée, Schönbein a inventé le terme « ozone » pour le nouveau gaz, du mot grec « ozein », qui signifie « sentir ». En 1839, Schönbein publie le principe de la pile à combustible dans le « Philosophical Magazine ».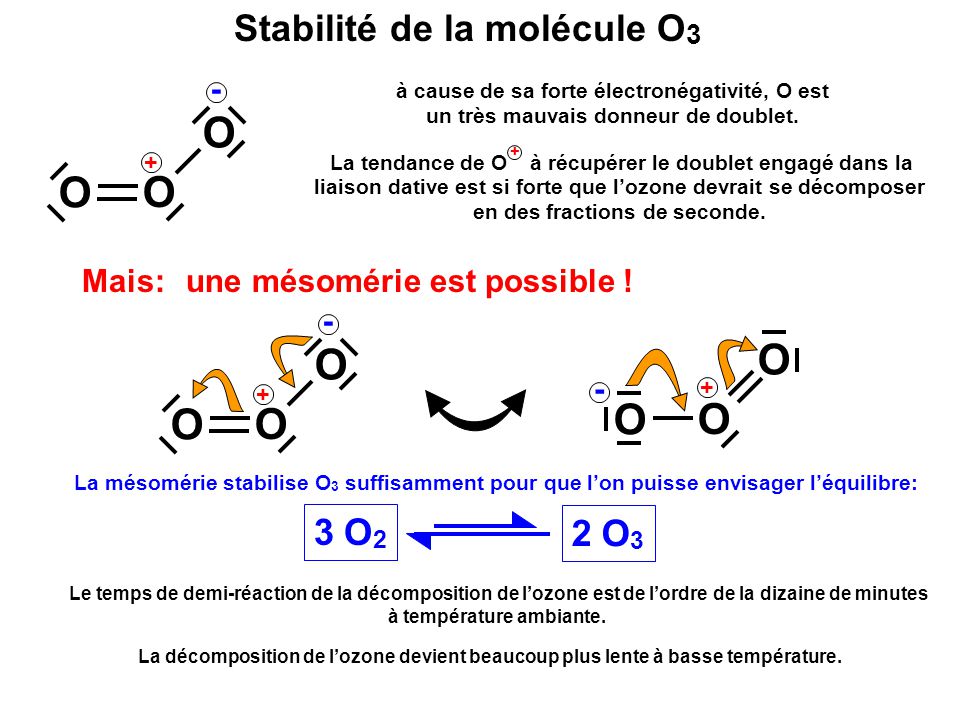 Qu’est-ce que la pile à combustible ?
Qu’est-ce que la pile à combustible ?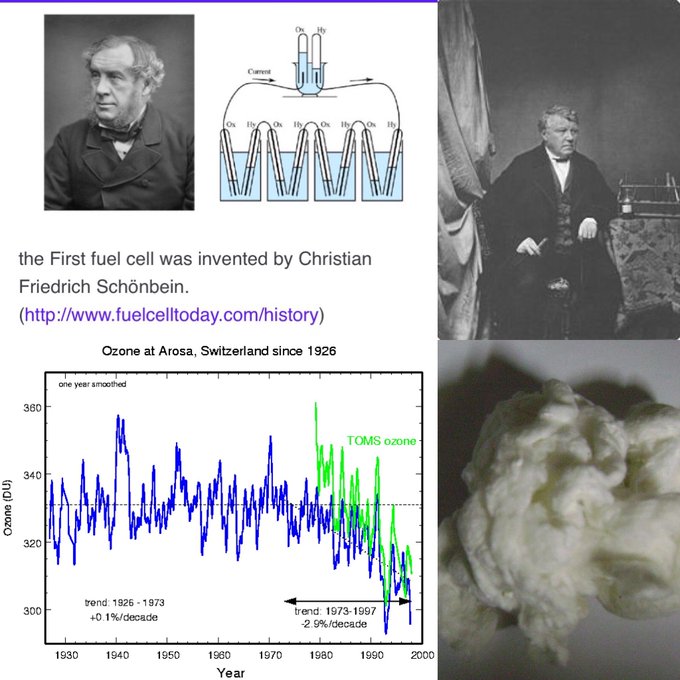

 Les piles à combustible sont utilisées pour l’alimentation primaire et de secours des bâtiments commerciaux, industriels et résidentiels et dans les zones éloignées ou inaccessibles. Les piles à combustible sont également utilisées pour alimenter les véhicules à pile à combustible, y compris les chariots élévateurs, les automobiles, les bus, les bateaux, les motos et les sous-marins.
Les piles à combustible sont utilisées pour l’alimentation primaire et de secours des bâtiments commerciaux, industriels et résidentiels et dans les zones éloignées ou inaccessibles. Les piles à combustible sont également utilisées pour alimenter les véhicules à pile à combustible, y compris les chariots élévateurs, les automobiles, les bus, les bateaux, les motos et les sous-marins. 
 Christian Schönbein a découvert et nommé l’ozone en 1840
Christian Schönbein a découvert et nommé l’ozone en 1840 L’ozone est une molécule inorganique incolore ou légèrement bleutée de formule chimique O3. C’est un gaz bleu pâle avec une odeur piquante caractéristique. L’ozone est un allotrope d’oxygène qui est beaucoup moins stable que l’allotrope diatomique O2, se décomposant dans la basse atmosphère en dioxygène normal. L’ozone se forme à partir du dioxygène sous l’action de la lumière ultraviolette ainsi que des décharges électriques atmosphériques. L’ozone est utilisé comme alternative au chlore ou au dioxyde de chlore dans le blanchiment de la pâte de bois. Il est souvent utilisé en conjonction avec de l’oxygène et du peroxyde d’hydrogène pour éliminer le besoin de composés contenant du chlore dans la fabrication de papier blanc de haute qualité. L’ozone peut être utilisé pour détoxifier les déchets de cyanure en oxydant le cyanure en cyanate et éventuellement en dioxyde de carbone.
L’ozone est une molécule inorganique incolore ou légèrement bleutée de formule chimique O3. C’est un gaz bleu pâle avec une odeur piquante caractéristique. L’ozone est un allotrope d’oxygène qui est beaucoup moins stable que l’allotrope diatomique O2, se décomposant dans la basse atmosphère en dioxygène normal. L’ozone se forme à partir du dioxygène sous l’action de la lumière ultraviolette ainsi que des décharges électriques atmosphériques. L’ozone est utilisé comme alternative au chlore ou au dioxyde de chlore dans le blanchiment de la pâte de bois. Il est souvent utilisé en conjonction avec de l’oxygène et du peroxyde d’hydrogène pour éliminer le besoin de composés contenant du chlore dans la fabrication de papier blanc de haute qualité. L’ozone peut être utilisé pour détoxifier les déchets de cyanure en oxydant le cyanure en cyanate et éventuellement en dioxyde de carbone.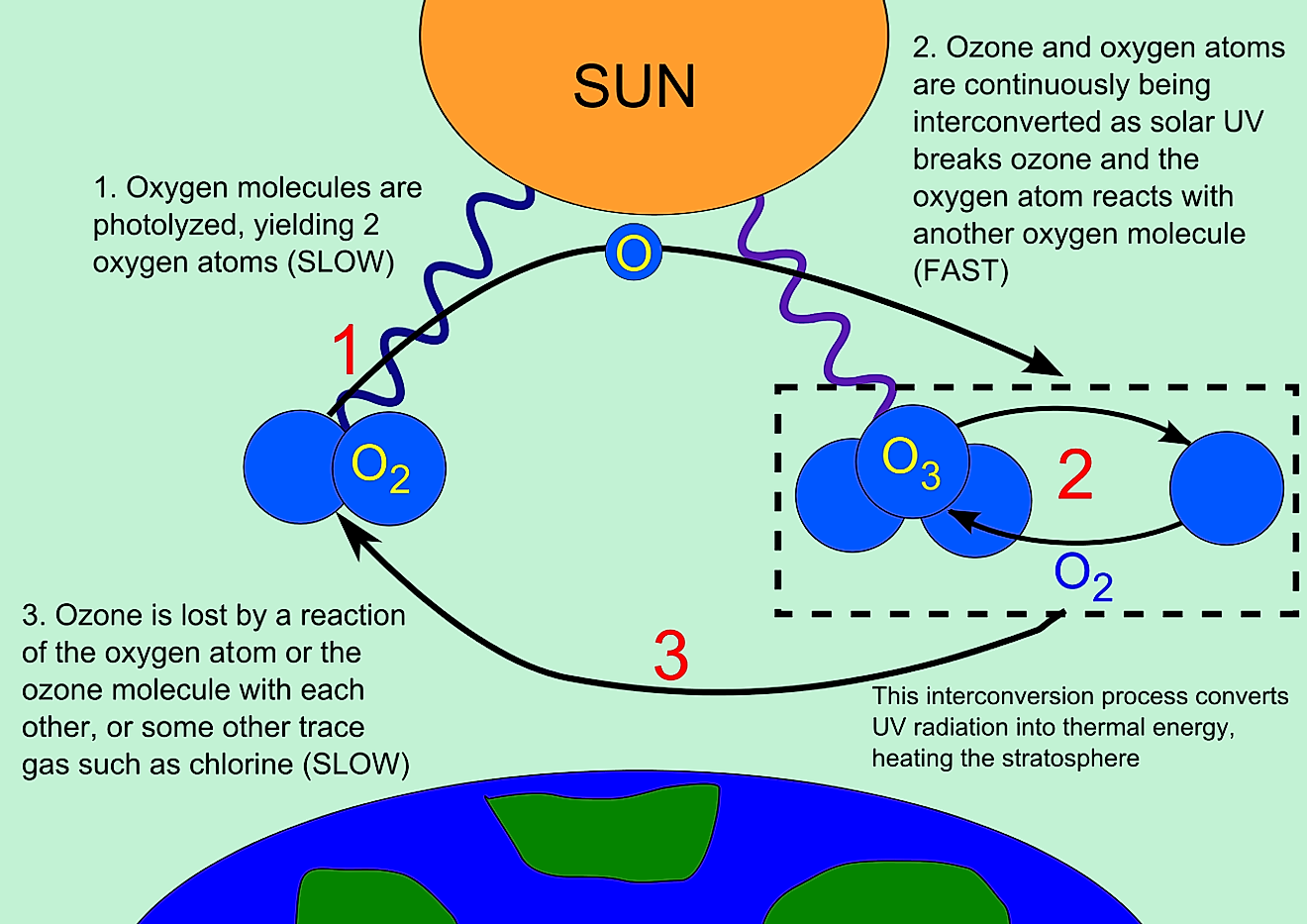 Ozone allotrope chimique
Ozone allotrope chimique
Ozone, (O3), allotrope triatomique de l’oxygène (une forme d’oxygène dans laquelle la molécule contient trois atomes au lieu de deux comme dans la forme courante) qui explique l’odeur distinctive de l’air après un orage ou autour d’un équipement électrique. L’odeur d’ozone autour des machines électriques a été signalée dès 1785 ; La constitution chimique de l’ozone a été établie en 1872.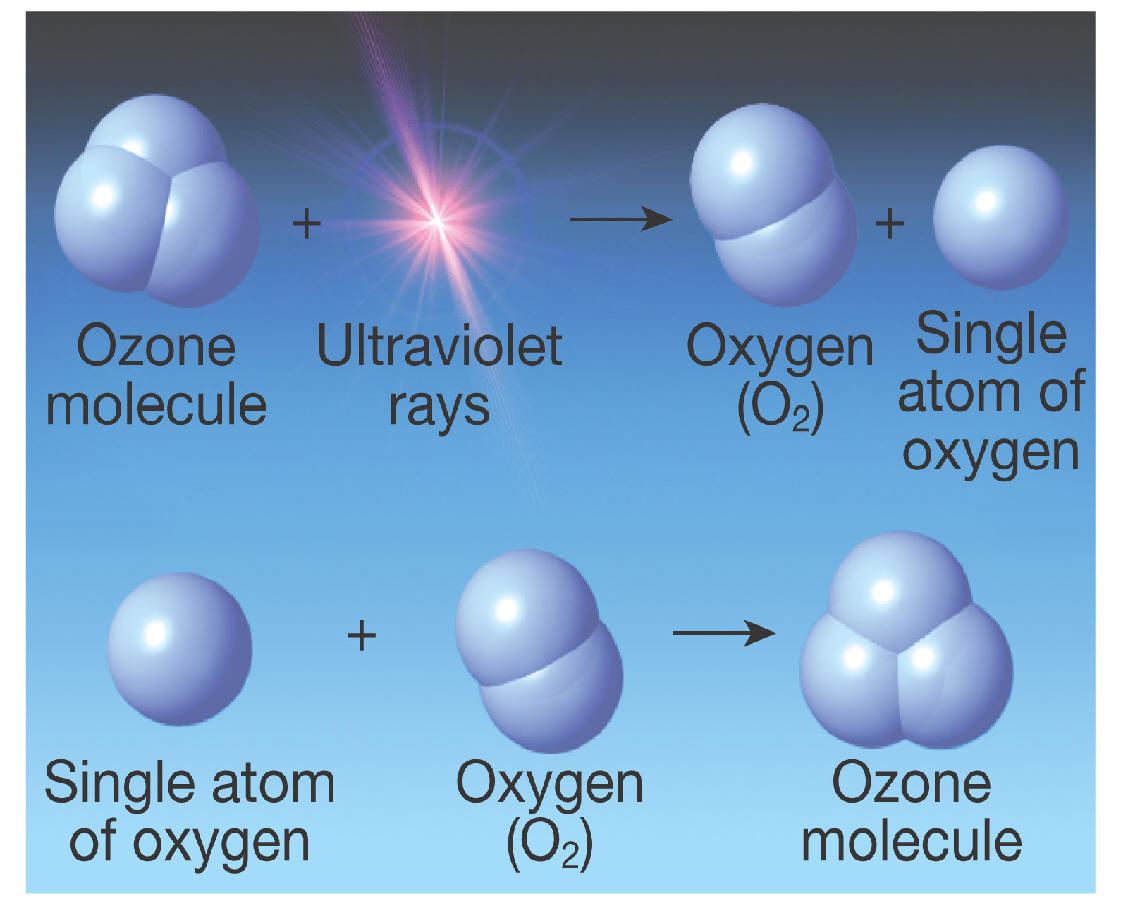 L’ozone est un gaz bleu pâle irritant, explosif et toxique, même à faible concentration. Il se produit naturellement en petites quantités dans la stratosphère terrestre, où il absorbe le rayonnement ultraviolet solaire, qui pourrait autrement causer de graves dommages aux organismes vivants à la surface de la Terre. Dans certaines conditions, les réactions photochimiques entre les oxydes d’azote et les hydrocarbures dans la basse atmosphère peuvent produire de l’ozone à des concentrations suffisamment élevées pour provoquer une irritation des yeux et des muqueuses.
L’ozone est un gaz bleu pâle irritant, explosif et toxique, même à faible concentration. Il se produit naturellement en petites quantités dans la stratosphère terrestre, où il absorbe le rayonnement ultraviolet solaire, qui pourrait autrement causer de graves dommages aux organismes vivants à la surface de la Terre. Dans certaines conditions, les réactions photochimiques entre les oxydes d’azote et les hydrocarbures dans la basse atmosphère peuvent produire de l’ozone à des concentrations suffisamment élevées pour provoquer une irritation des yeux et des muqueuses. L’ozone est généralement fabriqué en faisant passer une décharge électrique à travers un courant d’oxygène ou d’air sec. Les mélanges résultants d’ozone et de gaz d’origine conviennent à la plupart des usages industriels, bien que de l’ozone plus pur puisse être obtenu à partir d’eux par diverses méthodes ; par exemple, lors de la liquéfaction, un mélange oxygène-ozone se sépare en deux couches, dont la plus dense contient environ 75 % d’ozone. L’instabilité et la réactivité extrêmes de l’ozone concentré rendent sa préparation à la fois difficile et dangereuse.
L’ozone est généralement fabriqué en faisant passer une décharge électrique à travers un courant d’oxygène ou d’air sec. Les mélanges résultants d’ozone et de gaz d’origine conviennent à la plupart des usages industriels, bien que de l’ozone plus pur puisse être obtenu à partir d’eux par diverses méthodes ; par exemple, lors de la liquéfaction, un mélange oxygène-ozone se sépare en deux couches, dont la plus dense contient environ 75 % d’ozone. L’instabilité et la réactivité extrêmes de l’ozone concentré rendent sa préparation à la fois difficile et dangereuse.
L’ozone est 1,5 fois plus dense que l’oxygène ; à -112 ° C (-170 ° F), il se condense en un liquide bleu foncé, qui gèle à -251,4 ° C (-420 ° F). Le gaz se décompose rapidement à des températures supérieures à 100 °C (212 °F) ou, en présence de certains catalyseurs, à température ambiante. Bien qu’il ressemble à l’oxygène à bien des égards, l’ozone est beaucoup plus réactif ; par conséquent, c’est un agent oxydant extrêmement puissant, particulièrement utile pour convertir les oléfines en aldéhydes, cétones ou acides carboxyliques. Parce qu’il peut décolorer de nombreuses substances, il est utilisé commercialement comme agent de blanchiment pour les composés organiques ; en tant que germicide puissant, il est utilisé pour stériliser l’eau potable ainsi que pour éliminer les odeurs et les saveurs désagréables.
Découverte de l’ozone
Dans une lettre à François Arago (1786-1853), le chimiste allemand naturalisé suisse, Christian Schoenbein, expose ses recherches sur « la nature de l’odeur nommée électrique », la même « qui se dégage quand l’eau est décomposée par un courant voltaïque ». Il a fait, dit-il, beaucoup d’expériences inutiles. Il conclut néanmoins que « le principe odorant doit être classé au genre de corps auquel appartiennent le chlore et le brome, c’est-à-dire dans les substances élémentaires et hologènes », autrement dit oxydantes et constituées de molécules formées d’atomes du même élément, il ajoute : « je propose de lui donner le nom de ozone ».
Christian Friedrich Schönbein
Chimiste germano-suisse qui a découvert et nommé l’ozone (1840) et a été le premier à décrire le guncotton (nitrocellulose). Il a noté que l’ozone apparaissait pendant les orages et a nommé le gaz ozone pour son odeur particulière (ozo est le grec pour l’odeur). Des expériences ultérieures ont montré que l’envoi d’un courant électrique à travers de l’oxygène pur et sec (O2) crée de l’ozone (O3).
Sa découverte du puissant explosif appelé nitrate de cellulose, ou coton à canon, est le résultat d’un accident de laboratoire. Un jour de 1845, il renversa des acides sulfurique et nitrique et l’imbiba d’un tablier de coton. Une fois le tablier séché, il s’est enflammé- il avait créé de la cellulose nitrée. Il a découvert que le nitrate de cellulose pouvait être moulé et avait certaines propriétés élastiques. Il a finalement été utilisé pour la poudre à canon sans fumée.
https://www.mediachimie.org/ressource/d%C3%A9couverte-de-l%E2%80%99ozone
https://www.britannica.com/biography/Christian-Friedrich-Schonbein
https://physicstoday.scitation.org/do/10.1063/pt.6.6.20181018a/full/
https://inlibris.com/authors/christian-friedrich-schoenbein/