Il reçoit le prix Nobel de physiologie ou médecine en 1992 avec Edmond Fischer pour sa découverte de la phosphorylation réversible des protéines.
Il reçoit le prix Nobel de physiologie ou médecine en 1992 avec Edmond Fischer pour sa découverte de la phosphorylation réversible des protéines.
Edwin G. Krebs était un biochimiste américain renommé qui, avec Edmond H. Fischer, a remporté le prix Nobel de physiologie ou médecine en 1992. Krebs a perdu son père alors qu’il n’avait que quinze ans et l’incident a eu une triste répercussion sur son enfance autrement heureuse. Il a commencé à penser quoi faire de sa vie même lorsqu’il était lycéen. Finalement, il est entré à l’école de médecine de l’Université de Washington et a obtenu ses diplômes de médecine à l’âge de vingt-cinq ans. Après un court service militaire, il a été attiré par la recherche fondamentale et a rejoint l’Université de Washington, Seattle en tant que professeur adjoint au Département de biochimie. Là, avec Edmond H. Fischer, il a commencé à travailler sur l’enzymologie de la phosphorylase et en peu de temps, a découvert un processus biochimique appelé phosphorylation réversible des protéines, ce qui leur a valu le très convoité prix Nobel de nombreuses années plus tard. Plus tard, ils ont travaillé séparément sur différents aspects du processus. Il était doué d’une intelligence vive. Ses incroyables résultats de recherche lui ont valu un statut emblématique au sein de sa fraternité scientifique. Il a également été un mentor affectueux pour de nombreux étudiants et stagiaires postdoctoraux. Beaucoup d’entre eux se souviennent encore de lui comme d’un mentor gentil et doux.
 Carrière
Carrière
Edwin G. Krebs a obtenu son diplôme de médecine en 1943 et a rejoint l’hôpital Barnes, également à Saint-Louis, pour une résidence de 18 mois. À la fin de ses études, il rejoint la marine américaine en tant que médecin militaire en service actif dans le cadre du service de guerre.
En 1946, Krebs a été renvoyé de la Marine. Bien qu’il ait voulu rejoindre l’hôpital, il n’a pas obtenu le champ d’application immédiatement. Par la suite, il a rejoint l’Université de Washington à St. Louis et a commencé à travailler sur l’interaction de la protamine avec la phosphorylase du muscle de lapin sous Carl et Gerty Cori, en tant que boursier postdoctoral. La période postdoctorale de Krebs a pris fin en 1948. À ce moment-là, il avait décidé de poursuivre ses travaux de recherche. Par conséquent, lorsque l’offre est venue, il a rejoint avec plaisir l’Université de Washington, Seattle en tant que professeur adjoint au Département de biochimie.
La période postdoctorale de Krebs a pris fin en 1948. À ce moment-là, il avait décidé de poursuivre ses travaux de recherche. Par conséquent, lorsque l’offre est venue, il a rejoint avec plaisir l’Université de Washington, Seattle en tant que professeur adjoint au Département de biochimie.
Il a d’abord commencé à travailler sur le DPNH-X, un dérivé du NADH. Mais lorsqu’en 1953, Edmond H. Fischer arrive à l’université « les deux Eds » commencent à travailler sur l’enzymologie de la phosphorylase. Comme le département mettait l’accent sur la chimie des protéines et l’enzymologie, il offrait un excellent environnement pour leur travail.
Il faut se rappeler qu’avant de venir ici, Krebs avait travaillé avec les Coris sur la phosphorylase sur la phosphorylase du muscle de lapin. Là, ils avaient découvert que, pour que la phosphorylase fonctionne, l’AMP devait servir d’une sorte de cofacteur. Avant de venir ici, Fischer avait également travaillé sur la purification de la phosphorylase de la pomme de terre à l’Université de Genève avec le professeur Kurt H. Meyer, chef du département de chimie organique. Cependant, là, ils n’avaient pas besoin d’AMP.
Avant de venir ici, Fischer avait également travaillé sur la purification de la phosphorylase de la pomme de terre à l’Université de Genève avec le professeur Kurt H. Meyer, chef du département de chimie organique. Cependant, là, ils n’avaient pas besoin d’AMP.
Cependant, ils ont échoué dans leur mission ; mais dans le processus, ils ont découvert que la phosphorylase musculaire était régulée par phosphorylation-déphosphorylation et que le processus, connu sous le nom de phosphorylation réversible des protéines, régule divers processus cellulaires. Le dysfonctionnement de ce processus conduit à de nombreuses maladies mortelles. En 1957, Krebs est nommé professeur titulaire à l’Université de Washington. Depuis quelque temps, lui et Fischer ont commencé à travailler séparément sur différents domaines de la phosphorylation. L’équipe de Krebs a commencé à se concentrer sur le mécanisme d’action moléculaire de l’AMP cyclique dans la promotion de la phosphorylase b en réaction.
En 1957, Krebs est nommé professeur titulaire à l’Université de Washington. Depuis quelque temps, lui et Fischer ont commencé à travailler séparément sur différents domaines de la phosphorylation. L’équipe de Krebs a commencé à se concentrer sur le mécanisme d’action moléculaire de l’AMP cyclique dans la promotion de la phosphorylase b en réaction.
En 1968, Krebs a quitté l’Université de Washington, Seattle pour rejoindre l’Université de Californie. À l’Université de Californie, Krebs est devenu le président fondateur du Département de biochimie. Ici, il a recruté les meilleurs professeurs et a prouvé qu’il était également bon en administration. Quelque temps maintenant, il est également devenu membre du comité de rédaction du ‘Journal of Biological Chemistry et en 1972, il est devenu l’un de ses rédacteurs associés. Il est resté à ce poste jusqu’en 1992.
Quelque temps maintenant, il est également devenu membre du comité de rédaction du ‘Journal of Biological Chemistry et en 1972, il est devenu l’un de ses rédacteurs associés. Il est resté à ce poste jusqu’en 1992.
Pendant ce temps, en 1977, Krebs est retourné à l’Université de Washington, Seattle, en tant que président du département de pharmacologie. Parallèlement, il a également été nommé enquêteur pour le Howard Hughes Medical Institute. En 1983, après avoir reconstruit le département, Krebs s’est recentré sur la recherche et la formation de jeunes scientifiques. Il a maintenant commencé à résoudre de nouveaux problèmes de transduction du signal. Son équipe a contribué de manière significative à l’analyse des événements de signalisation de la phosphotyrosine. Ses découvertes ont ensuite permis de découvrir une nouvelle cascade de phosphorylation – la voie MAP kinase.
En 1983, après avoir reconstruit le département, Krebs s’est recentré sur la recherche et la formation de jeunes scientifiques. Il a maintenant commencé à résoudre de nouveaux problèmes de transduction du signal. Son équipe a contribué de manière significative à l’analyse des événements de signalisation de la phosphotyrosine. Ses découvertes ont ensuite permis de découvrir une nouvelle cascade de phosphorylation – la voie MAP kinase.
Krebs avait également nombre de livres à son actif. ‘The Enzymes’ (1970, avec Paul D. Boyer et DS Sigman), ‘Protein Phosphorylation’ (1981, avec Ora M Rosen) et ‘Control by Phosphorylation’ (1986, avec Paul D. Boyer) sont les plus significatifs d’entre eux. . Grands travaux
Grands travaux
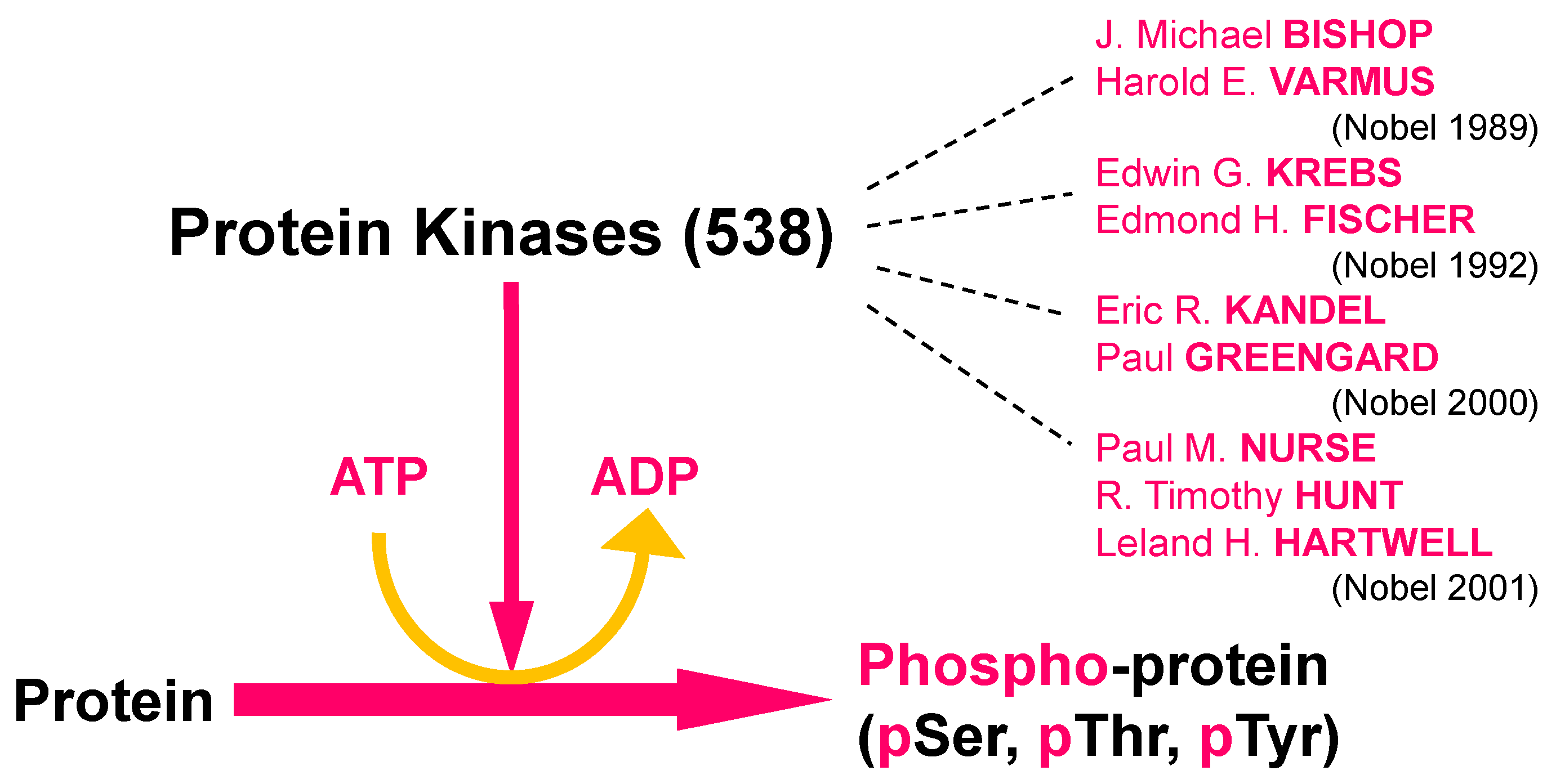
Krebs est surtout connu pour ses travaux sur la phosphorylation réversible des protéines, un mécanisme biochimique qui régule les activités des cellules. Il a commencé ses études avec Edmond H. Fischer pour découvrir comment les muscles tirent leur énergie du glycogène et quel rôle l’AMP a dans la phosphorylation.
Lorsque le travail est terminé, une protéine phosphatase désactive la protéine en éliminant le phosphate. Le processus régule un certain nombre de fonctions biologiques telles que la mobilisation du glucose à partir du glycogène, la prévention du rejet de greffe, le développement d’un cancer comme la leucémie myéloïde chronique, etc. En 1992, Edwin G. Krebs et Edmond H. Fischer ont reçu conjointement le prix Nobel de philosophie ou de médecine « pour leurs découvertes concernant la phosphorylation réversible des protéines en tant que mécanisme de régulation biologique ».
En 1992, Edwin G. Krebs et Edmond H. Fischer ont reçu conjointement le prix Nobel de philosophie ou de médecine « pour leurs découvertes concernant la phosphorylation réversible des protéines en tant que mécanisme de régulation biologique ».
En 1989, Krebs a reçu le prix Louisa Gross Horwitz de biologie ou de biochimie de l’Université Columbia et le prix Albert Lasker de recherche médicale fondamentale de la Fondation Laskar.
Edwin G. Krebs (1918-2009) – Auto Biographie
 À la fin de ma première année au lycée, mon père est décédé subitement. J’avais quinze ans et j’ai été fortement marqué par cet événement inattendu. Bien que je n’aie jamais aspiré à suivre ses traces et à devenir ministre, j’avais une grande affection pour lui et j’admirais l’habileté qu’il avait dans certaines de ses vocations telles que la menuiserie et le jardinage. Ma mère a été profondément affectée par la mort de papa, mais après s’être remise du choc initial, elle a commencé à prendre des décisions importantes, principalement centrées sur l’offre d’opportunités éducatives avancées à ses enfants. Il a été décidé que la famille, qui avait des revenus très limités (c’était en 1933), déménagerait à Urbana, Illinois, où mes deux frères aînés étaient déjà inscrits à l’Université de l’Illinois. Là, nous avons loué une maison assez grande pour pouvoir louer une chambre pour aider aux dépenses. Tout le monde a obtenu une sorte de travail à temps partiel. La planification de ces changements a impliqué toute la famille et a sans aucun doute eu une influence de maturation sur mes deux frères et en a certainement eu une sur moi.
À la fin de ma première année au lycée, mon père est décédé subitement. J’avais quinze ans et j’ai été fortement marqué par cet événement inattendu. Bien que je n’aie jamais aspiré à suivre ses traces et à devenir ministre, j’avais une grande affection pour lui et j’admirais l’habileté qu’il avait dans certaines de ses vocations telles que la menuiserie et le jardinage. Ma mère a été profondément affectée par la mort de papa, mais après s’être remise du choc initial, elle a commencé à prendre des décisions importantes, principalement centrées sur l’offre d’opportunités éducatives avancées à ses enfants. Il a été décidé que la famille, qui avait des revenus très limités (c’était en 1933), déménagerait à Urbana, Illinois, où mes deux frères aînés étaient déjà inscrits à l’Université de l’Illinois. Là, nous avons loué une maison assez grande pour pouvoir louer une chambre pour aider aux dépenses. Tout le monde a obtenu une sorte de travail à temps partiel. La planification de ces changements a impliqué toute la famille et a sans aucun doute eu une influence de maturation sur mes deux frères et en a certainement eu une sur moi.
Dans la période de 1933 à 1940 à Urbana, j’ai terminé les trois dernières années du lycée et effectué des travaux de premier cycle à l’Université de l’Illinois. Urbana High School était une excellente institution avec des enseignants très dévoués et un large éventail d’activités parascolaires qui m’ont été utiles pour me décider sur ce que je voulais faire dans la vie. Ce problème était celui qui occupait de plus en plus mon esprit à cette époque. Parce que c’étaient des années de dépression, ma réflexion sur diverses professions était teintée par la question de savoir si oui ou non un choix de travail donné était celui dans lequel je pouvais gagner ma vie. Je me suis tourné vers une carrière scientifique, non pas à cause d’un profond intérêt pour les défis de l’inconnu, mais parce que je sentais qu’il y avait de la sécurité à devenir scientifique. Les filières scientifiques, plus que les autres, fourni un sujet qui, à mon avis, pourrait être utilisé. Ces sentiments ont été fortement renforcés par le succès de mon frère aîné à obtenir un excellent poste après l’obtention d’un doctorat en génie chimique au milieu des années 1930. La médecine, en tant que science appliquée, était également attrayante et offrait l’avantage de s’occuper directement des gens. En 1936, je suis entré à l’Université de l’Illinois avec l’idée de me spécialiser dans une branche scientifique liée à la chimie, mais je n’avais pas une idée très précise de l’endroit où j’allais. Profitant d’un programme de « programme individuel » qui était disponible pour ceux qui avaient des résultats scolaires raisonnablement bons – et pour cette raison, je savais probablement où ils allaient – j’étais soulagé de la nécessité de répondre à de nombreuses exigences spécifiques et je pouvais choisir les cours que je recherché. De cette façon, j’ai pu suivre suffisamment de cours de biologie pour répondre aux exigences prémédicales, mais j’ai également pu suivre les cours de mathématiques, de chimie et de physique destinés aux professionnels de ces domaines. Au début de ma quatrième année à l’université, j’avais limité mes choix entre l’obtention d’un diplôme supérieur en chimie organique ou la faculté de médecine. Pour ce dernier, une aide financière serait nécessaire. Cela est devenu disponible sous la forme d’une bourse pour fréquenter la Washington University School of Medicine à St. Louis. À ce stade, j’ai supposé que l’agonie de l’indécision était terminée et que mon avenir était maintenant défini. Je deviendrais médecin.
En 1936, je suis entré à l’Université de l’Illinois avec l’idée de me spécialiser dans une branche scientifique liée à la chimie, mais je n’avais pas une idée très précise de l’endroit où j’allais. Profitant d’un programme de « programme individuel » qui était disponible pour ceux qui avaient des résultats scolaires raisonnablement bons – et pour cette raison, je savais probablement où ils allaient – j’étais soulagé de la nécessité de répondre à de nombreuses exigences spécifiques et je pouvais choisir les cours que je recherché. De cette façon, j’ai pu suivre suffisamment de cours de biologie pour répondre aux exigences prémédicales, mais j’ai également pu suivre les cours de mathématiques, de chimie et de physique destinés aux professionnels de ces domaines. Au début de ma quatrième année à l’université, j’avais limité mes choix entre l’obtention d’un diplôme supérieur en chimie organique ou la faculté de médecine. Pour ce dernier, une aide financière serait nécessaire. Cela est devenu disponible sous la forme d’une bourse pour fréquenter la Washington University School of Medicine à St. Louis. À ce stade, j’ai supposé que l’agonie de l’indécision était terminée et que mon avenir était maintenant défini. Je deviendrais médecin.
Au cours de ma quatrième année à l’Université de l’Illinois, j’ai effectué des recherches de premier cycle en chimie organique et j’ai trouvé que c’était une expérience fascinante. C’était probablement la première fois que je suivais un « cours » qui semblait amusant. Parce que j’étais en avance dans mes crédits, j’ai pu passer un temps pratiquement illimité au laboratoire. Mes mentors étaient Harold Snyder et Charles Price, et je leur serai toujours reconnaissant de m’avoir initié à la recherche. Un autre enseignant influent au cours de cette période était Carl S. Marvel. Si cette expérience de recherche était survenue plus tôt dans ma carrière universitaire, j’aurais bien pu opter pour un doctorat en chimie organique plutôt que d’aller à l’école de médecine. Mais comme il s’est avéré,
L’école de médecine de l’Université de Washington s’est avérée être un excellent choix comme lieu où je pouvais recevoir une formation médicale classique tout en apprenant à apprécier la « recherche médicale ». Les cours de sciences de base étaient l’équivalent des cours d’études supérieures et il n’y avait aucune tentative d’édulcorer le programme en se basant sur l’idée que les médecins n’avaient besoin que de connaissances « de base » dans les diverses sciences. En plus des cours de base qui nous ont amenés à la périphérie des connaissances dans les différentes disciplines, les étudiants ont été encouragés à participer à des projets de laboratoire. J’ai personnellement entrepris plusieurs projets, d’abord sous la direction du doyen Philip A. Schafer, qui était également président du département de biochimie, puis sous la direction d’Arda A. Green, membre du corps professoral associé au Dr Carl et Gerty Cori. Ethel Ronzoni m’a également offert de l’aide et des conseils dans certains des travaux que j’ai effectués. Au cours de cette période, j’ai entendu parler pour la première fois de l’enzyme, la phosphorylase, qui a été cristallisée par Arda Green et les Coris et qui s’est avérée exister sous deux formes interconvertibles qu’ils ont appelées phosphorylase b et phosphorylase a . La phosphorylase b nécessitait du 5′-AMP pour l’activité enzymatique alors que la phosphorylase a était active sans ce nucléotide. Cette enzyme devait plus tard jouer un rôle important dans ma vie.
Les années d’études médicales, 1940-1943, étaient des années de guerre, et bien que j’aie fait quelques recherches en tant qu’étudiant en médecine, ma principale préoccupation était de devenir un médecin qui pourrait servir dans les forces armées. Personne ne savait combien de temps durerait la guerre et nos préoccupations immédiates étaient de faire partie de l’effort de guerre. Après avoir obtenu mon diplôme de médecine, j’ai suivi dix-huit mois de résidence en médecine interne à l’hôpital Barnes de St. Louis, puis j’ai été en service actif en tant que cabinet médical dans la marine. La guerre a pris fin, tout comme la période de ma vie pendant laquelle j’ai activement utilisé ma formation médicale dans un sens pratique. Je crois que j’aurais été heureux de pratiquer la médecine, mais ce n’était pas le cas.
Après avoir été libéré de la Marine en 1946, je suis retourné à Saint-Louis avec l’idée de poursuivre ma résidence et de devenir interniste universitaire. Cependant, il est immédiatement devenu évident que je devrais attendre mon tour pour reprendre le travail à l’hôpital, et mon professeur de médecine, le Dr WB Wood, m’a conseillé d’étudier dans un département de sciences fondamentales pendant l’intérim. En raison de ma formation en chimie, j’ai choisi la biochimie pour cela et j’ai eu la chance d’être accepté par le Dr Carl et Gerty Cori comme boursier postdoctoral. Après deux ans dans leur laboratoire, au cours desquels j’ai étudié l’interaction de la protamine avec la phosphorylase du muscle de lapin. De nouveau, je suis devenu tellement amoureux de la biochimie que j’ai décidé de rester dans ce domaine plutôt que de retourner à la médecine interne.
Pendant que j’étais en service actif dans la marine, mon navire avait fait escale à Seattle et j’avais été impressionné par la beauté de la ville. Alors en 1948, quand j’ai eu l’occasion d’y aller comme professeur adjoint de biochimie, j’ai sauté sur l’occasion. Cependant, comme j’étais assez incertain de ma capacité à réussir en biochimie, je me suis assuré que j’étais dûment autorisé et enregistré dans l’État de Washington, de sorte que si le pire venait à empirer, je pourrais toujours « traîner mon bardeau ». Heureusement, les choses semblaient se dérouler raisonnablement bien et je n’ai pas jugé nécessaire d’utiliser cette police d’assurance.
En 1950, Hans Neurath est devenu le premier président permanent du Département de biochimie de l’Université de Washington et a commencé à construire ce qui allait devenir l’un des principaux départements du pays. Le département mettait l’accent sur la chimie des protéines et l’enzymologie, ce qui offrait un excellent environnement dans lequel développer et poursuivre un domaine de recherche. J’étais à Seattle depuis cinq ans quand Ed Fischer a rejoint le département. Ed avait fait l’expérience de la phosphorylase de la pomme de terre pendant ses études supérieures et, comme indiqué précédemment, j’avais fait la connaissance de la phosphorylase du muscle squelettique des mammifères à Saint-Louis. Ensemble, nous avons décidé de voir si nous pouvions ou non déterminer le mécanisme par lequel le 5′-AMP servait d’activateur de la phosphorylase b. Nous n’avons pas résolu ce problème, mais au cours de nos essais, nous avons découvert le mécanisme moléculaire par lequel se produit l’interconversion des deux formes de phosphorylase ; à savoir, la phosphorylation réversible des protéines. Des travaux similaires étaient menés sur la phosphorylase hépatique à peu près au même moment dans le laboratoire d’Earl Sutherland qui découvrit l’AMP cyclique, le deuxième messager de l’action hormonale, dont il montra qu’il était impliqué dans la formation de la phosphorylase a . Plusieurs années devaient s’écouler avant qu’il devienne évident que la phosphorylation réversible des protéines est un processus général affectant d’innombrables protéines cellulaires.
Au cours des premières années de nos travaux sur la phosphorylation des protéines, Ed Fischer et moi avons travaillé ensemble très étroitement au point même que si l’un devait partir pour donner une conférence, l’autre pouvait poursuivre l’expérience du jour. Plus tard, au fur et à mesure que le domaine se développait, nous nous concentrions chacun sur nos propres domaines spécifiques liés au problème central. L’un de mes propres projets portait sur le mécanisme d’action moléculaire de l’AMP cyclique dans la promotion de la phosphorylase b en réaction. Cela a finalement été résolu avec la découverte de la protéine kinase dépendante de l’AMP cyclique par l’un de mes boursiers postdoctoraux, Donal A. Walsh. Cette découverte s’est produite juste avant que je quitte l’Université de Washington en 1968. En plus de la motivation apportée par mes recherches, j’étais également motivé par des intérêts pour l’enseignement et divers aspects de
En plus de la motivation apportée par mes recherches, j’étais également motivé par des intérêts pour l’enseignement et divers aspects de
Une partie importante de cette esquisse autobiographique, que j’ai gardée pour la fin, concerne ma famille. Au cours de mes années de résidence à l’hôpital Barnes, j’ai rencontré ma femme, Deedy, qui était étudiante infirmière à l’Université de Washington. Nous nous sommes mariés en 1945 peu de temps avant mon départ pour servir dans la Marine. Nous avons eu trois enfants, Sally, Robert et Martha et avons maintenant cinq petits-enfants. Après avoir obtenu son diplôme en soins infirmiers, ma femme a abandonné sa propre carrière, mais elle a été une source constante et importante de soutien pour moi dans la mienne. Nous avons partagé les grandes décisions de nos vies, et je pense que je lui dois beaucoup, non seulement pour son aide constante dans ma carrière, mais aussi pour m’avoir fait prendre conscience qu’il y a d’autres aspects importants de la vie.
Edwin G. Krebs (1918-2009)
Edwin Gerhard Krebs était un biochimiste américain qui a partagé (avec Edmond H. Fischer) le prix Nobel de physiologie ou médecine en 1992. Ils ont découvert la phosphorylation réversible des protéines, un processus biochimique qui régule les activités des protéines dans les cellules et régit ainsi d’innombrables processus nécessaires à la vie. Des dysfonctionnements de la phosphorylation des protéines ont été impliqués dans l’étiologie de maladies telles que le diabète, le cancer et la maladie d’Alzheimer.
https://www.thefamouspeople.com/profiles/edwin-g-krebs-7491.php
https://www.nobelprize.org/prizes/medicine/1992/krebs/biographical/