 Walther Nernst et la troisième loi de la thermodynamique
Walther Nernst et la troisième loi de la thermodynamique



 En 1918, ses études de photochimie le conduisent à sa théorie de la réaction en chaîne des atomes. Cela supposait qu’une fois que l’énergie d’un quantum a initié une réaction dans laquelle des atomes libres sont formés, ces atomes formés peuvent eux-mêmes décomposer d’autres molécules avec la libération de plus d’atomes libres et ainsi de suite. La réaction peut ainsi se poursuivre pendant de longues périodes sans autres initiations extérieures. Nernst avait l’esprit mécanique et il était toujours à l’avant-garde dans l’examen des moyens d’appliquer les résultats de la recherche scientifique à l’industrie. Sa lampe électrique améliorée, la lampe Nernst, utilisait un corps en céramique et elle aurait pu prendre de l’importance si des filaments de tantale et de tungstène n’avaient pas été développés. Son piano électrique, qui a remplacé la table d’harmonie par des amplificateurs radio, n’a pas été accepté par les musiciens. Plus tard, il s’occupa des théories astrophysiques, un domaine dans lequel le théorème de la chaleur avait d’importantes applications. Pour ses travaux en thermochimie, il a reçu le prix Nobel de chimie en 1920. De nombreuses autres distinctions et récompenses lui ont été décernées pour ses contributions à la science.
En 1918, ses études de photochimie le conduisent à sa théorie de la réaction en chaîne des atomes. Cela supposait qu’une fois que l’énergie d’un quantum a initié une réaction dans laquelle des atomes libres sont formés, ces atomes formés peuvent eux-mêmes décomposer d’autres molécules avec la libération de plus d’atomes libres et ainsi de suite. La réaction peut ainsi se poursuivre pendant de longues périodes sans autres initiations extérieures. Nernst avait l’esprit mécanique et il était toujours à l’avant-garde dans l’examen des moyens d’appliquer les résultats de la recherche scientifique à l’industrie. Sa lampe électrique améliorée, la lampe Nernst, utilisait un corps en céramique et elle aurait pu prendre de l’importance si des filaments de tantale et de tungstène n’avaient pas été développés. Son piano électrique, qui a remplacé la table d’harmonie par des amplificateurs radio, n’a pas été accepté par les musiciens. Plus tard, il s’occupa des théories astrophysiques, un domaine dans lequel le théorème de la chaleur avait d’importantes applications. Pour ses travaux en thermochimie, il a reçu le prix Nobel de chimie en 1920. De nombreuses autres distinctions et récompenses lui ont été décernées pour ses contributions à la science. Les contributions fondamentales de Walther Nernst à l’électrochimie, à la théorie des solutions, à la thermodynamique, à la chimie du solide et à la photochimie sont consignées dans une série de monographies, et dans ses nombreux articles aux sociétés savantes, etc. Son livre Theoretische Chemie vom Standpunkte der Avogadro’schen Regel und der Thermodynamik (Chimie théorique du point de vue de la règle d’Avogadro et de la thermodynamique) a été publié pour la première fois en 1893 et la dixième édition est apparue en 1921 (la cinquième édition anglaise en 1923). Avec A. Schonflies, il a écrit un manuel Einführung in die mathematische Behandlung der Naturwissenschaften (Introduction à l’étude mathématique des sciences naturelles), qui a atteint sa dixième édition en 1923. Parmi ses autres livres, sa monographie Die theoretischen und experimentellen Grundlagen des neuen Wärmesatzes (1918, deuxième édition 1923) a également été publié en anglais (The New Heat Theorem, 1926).
Les contributions fondamentales de Walther Nernst à l’électrochimie, à la théorie des solutions, à la thermodynamique, à la chimie du solide et à la photochimie sont consignées dans une série de monographies, et dans ses nombreux articles aux sociétés savantes, etc. Son livre Theoretische Chemie vom Standpunkte der Avogadro’schen Regel und der Thermodynamik (Chimie théorique du point de vue de la règle d’Avogadro et de la thermodynamique) a été publié pour la première fois en 1893 et la dixième édition est apparue en 1921 (la cinquième édition anglaise en 1923). Avec A. Schonflies, il a écrit un manuel Einführung in die mathematische Behandlung der Naturwissenschaften (Introduction à l’étude mathématique des sciences naturelles), qui a atteint sa dixième édition en 1923. Parmi ses autres livres, sa monographie Die theoretischen und experimentellen Grundlagen des neuen Wärmesatzes (1918, deuxième édition 1923) a également été publié en anglais (The New Heat Theorem, 1926). Nernst a épousé Emma Lohmeyer en 1892. Ils ont eu deux fils, qui ont tous deux été tués pendant la Première Guerre mondiale, et trois filles. Ses passe-temps favoris étaient la chasse et la pêche. Il meurt à Berlin le 18 novembre 1941.
Nernst a épousé Emma Lohmeyer en 1892. Ils ont eu deux fils, qui ont tous deux été tués pendant la Première Guerre mondiale, et trois filles. Ses passe-temps favoris étaient la chasse et la pêche. Il meurt à Berlin le 18 novembre 1941. Walther Nernst et la troisième loi de la thermodynamique
Walther Nernst et la troisième loi de la thermodynamique
Le 25 juin 1864, le physicien allemand Walther Hermann Nernst est né. L’un des fondateurs de la chimie physique moderne, il est surtout connu pour ses théories sur le calcul de l’affinité chimique telle qu’incarnée dans la troisième loi de la thermodynamique, pour laquelle il a remporté le prix Nobel de chimie en 1920. Nernst a contribué à l’électrochimie, la thermodynamique et la physique du solide. Il est également connu pour avoir développé l’équation de Nernst. « Aucun effet nécessitant une précision de mesure supérieure à 10% ne mérite d’être étudié. » — Walther Hermann Nernst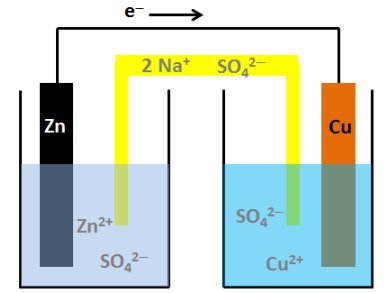 Walther Nernst – Premières années
Walther Nernst – Premières années
Nernst est né à Briesen en Prusse occidentale (aujourd’hui Wąbrzeźno, Pologne) de Gustav Nernst, un juge de campagne, et d’Ottilie Nerger. Nernst avait trois sœurs aînées et un frère cadet. La troisième sœur est morte du choléra. Nernst est allé à l’école primaire à Graudenz et est allé étudier aux universités de Zurich, Berlin et Graz. Il a commencé ses études en 1883 en Suisse et a déménagé à Berlin en 1885. À partir de 1886, il a pu approfondir ses intérêts physiques avec Ludwig Boltzmann. Avec son assistant Albert von Ettingshausen, tous deux ont rapidement découvert l’effet Ettingshausen-Nernst, et Heinrich Streintz a soutenu la discussion mathématique à Graz. Friedrich Kohlrausch lui offrit un poste de doctorat à Würzburg à la fin de 1886 pour poursuivre ses travaux sur le sujet, car l’Université de technologie de Graz n’obtint le droit de faire son doctorat qu’en 1902. En mai 1887, Nernst obtint son diplôme avec une thèse sur « Über die elektromotorischen Kräfte, welche durch den Magnetismus in von einem Wärmestrome durchflossenen Metallplatten geweckt werden“ (forces électromotrices produites par le magnétisme dans des plaques métalliques chauffées).
Sa thèse d’habilitation sur « L’efficacité électromotrice des ions », achevée à Leipzig en 1889, a confirmé les idées modèles sur les ions développées à l’origine par Arrhenius et développées plus tard par Ostwald. En 1890, pour une courte durée, il a travaillé comme chargé de cours privé (Privatdozent) à l’Université de Heidelberg, puis il a déménagé à l’Université de Göttingen, où il a été assistant d’Eduard Riecke et a été nommé professeur associé en 1891 et professeur titulaire en 1895 pour la chaire de chimie physique à Göttingen, où il a ensuite fondé l’Institut de chimie physique et d’électrochimie. Au milieu des années 1900, Nernst a été nommé professeur de chimie, plus tard de physique, à l’Université de Berlin. Il est devenu le directeur du Physikalisch-Chemisches Institut nouvellement fondé en 1924 et y est resté jusqu’à sa retraite.
On pense que les premiers travaux de recherche de Walther Nernst en électrochimie ont été inspirés par la théorie de la dissociation d’Arrhenius qui mettait l’accent sur les ions en solution. Il a ensuite élucidé la théorie des cellules galvaniques en supposant une «pression électrolytique de dissolution» qui force les ions des électrodes en solution et qui s’oppose à la pression osmotique des ions dissous. Nernst a également dérivé des équations définissant les conditions dans lesquelles les solides précipitent à partir de solutions saturées.
Heure à Wurtzbourg
La formation scientifique de Walther Nernst dans les domaines de la physique, des mathématiques et de la chimie s’est déroulée à partir de 1883 dans les universités de Zurich, Berlin et Graz. À Würzburg, Nernst a pu poursuivre ses recherches. Le physicien Friedrich Kohlrausch a offert à Nernst un poste de doctorat à Würzburg et déjà un an plus tard, il a obtenu sa promotion sur l’effet Nernst-Ettingshausen. Grâce à la connaissance de Svante Arrhenius, qu’il fit à Würzburg, Nernst rencontra Wilhelm Ostwald peu de temps après sa qualification de conférencier postdoctoral, qui l’invita à nouveau à habiliter à Leipzig.
Succès commercial et scientifique
L’un des succès scientifiques les plus populaires de Walther Nernst était la soi-disant «lampe Nernst», une lampe à incandescence électrolytique qui était un prédécesseur de l’ampoule. En 1897, il fait breveter son invention et vend le brevet deux ans plus tard à AEG pour un million de Reichsmark. Néanmoins, son invention n’a jamais été définitivement établie dans le marché, ce qui était probablement dû à son utilisation peu pratique : il devait être préchauffé avant de pouvoir être utilisé. La lampe Nernst a été rapidement remplacée par l’ampoule à incandescence plus pratique. Walther Nernst n’a pas seulement connu un succès commercial, mais a également pu briller par ses découvertes académiques : il a ajouté aux lois de la thermodynamique en ajoutant la troisième loi, qui dit qu' »il est impossible pour tout processus, aussi idéalisé soit-il,[1] Pour ses recherches dans ce domaine, il a reçu le prix Nobel de chimie en 1920.
Recherche en Thermodynamique
Le théorème de la chaleur de Walther Nernst, également connu sous le nom de troisième loi de la thermodynamique, a été développé en 1906. Le scientifique a démontré que le travail maximum pouvant être obtenu à partir d’un processus pouvait être calculé à partir de la chaleur dégagée à des températures proches du zéro absolu. Ce travail a fourni un moyen de déterminer les énergies libres des réactions chimiques à partir des mesures de chaleur. A Berlin, Nernst et ses étudiants ont procédé à de nombreuses mesures physico-chimiques importantes, en particulier des déterminations des chaleurs spécifiques des solides à très basses températures et des densités de vapeur à hautes températures. Tout cela a été considéré du point de vue de la théorie quantique.
Première Guerre mondiale et guerre du gaz
Au début de la Première Guerre mondiale, Nernst s’est enrôlé dans le corps des chauffeurs volontaires. Il soutint l’armée allemande contre les accusations de barbarie de son adversaire en signant le Manifeste des Quatre-vingt-treize. Le 21 août 1914, il conduisit des documents de Berlin au commandant de l’aile droite allemande en France, avançant avec eux pendant deux semaines jusqu’à ce qu’il puisse voir la lueur des lumières de Paris la nuit. Le vent a tourné à la bataille de la Marne. Lorsque l’impasse dans les tranchées a commencé, il est rentré chez lui. Il contacte le colonel Max Bauer, officier d’état-major chargé des munitions, avec l’idée de chasser les défenseurs de leurs tranchées avec des obus libérant des gaz lacrymogènes. Lorsque son idée a été mise à l’essai, l’un des observateurs était Fritz Haber, qui a soutenu qu’il faudrait trop d’obus, il serait préférable de libérer un nuage de gaz toxique plus lourd que l’air ; la première attaque de nuage de chlore le 22 avril 1915 n’a pas été soutenue par une forte poussée d’infanterie, de sorte que la chance que le gaz sorte de l’impasse était irrévocablement disparue. En 1920, lui et sa famille ont brièvement fui à l’étranger parce qu’il était l’un des scientifiques figurant sur la liste alliée des criminels de guerre. L’attribution du prix Nobel à Max Planck et Fritz Haber pour 1918 en 1919, à Johannes Stark pour 1919 et à Nernst pour 1920 en 1921 a parfois suscité des commentaires critiques à l’étranger, mais a montré que les gouvernements alliés et la communauté scientifique internationale ne voulaient pas poursuivre le sujet plus loin. Alors que la liste de la Commission de contrôle militaire interalliée en février 1920 comprenait près de 900 personnes recherchées pour extradition, en mai 1920, elle se réduisit à 45 noms et ne contenait plus ni Nernst ni Haber.
Années ultérieures
En 1918, Nernst a établi sa théorie de la réaction en chaîne des atomes, en supposant qu’une fois que l’énergie d’un quantum a initié une réaction dans laquelle des atomes libres se forment, ces atomes formés peuvent eux-mêmes décomposer d’autres molécules avec la libération de plus d’atomes libres et ainsi de suite. . La réaction peut ainsi se poursuivre pendant de longues périodes sans autres initiations extérieures. Son livre « Theoretische Chemie vom Standpunkte der Avogadro’schen Regel und der Thermodynamik » (La chimie théorique du point de vue de la règle d’Avogadro et de la thermodynamique) a été publié pour la première fois en 1893 et la dixième édition est parue en 1921 (la cinquième édition anglaise en 1923). Walther Nernst a eu une grave crise cardiaque en 1939. Il est décédé en 1941 et est enterré près de Max Planck, Otto Hahn et Max von Laue à Göttingen, en Allemagne.
Walther Hermann Nernst (1864-1941)
Physico-chimiste allemand qui fut l’un des fondateurs de la chimie physique moderne. En 1889, il a conçu sa théorie du potentiel électrique et de la conduction des solutions électrolytiques (l’équation de Nernst) et a introduit le produit de solubilité pour expliquer les réactions de précipitation. En 1906, Nernst a montré qu’il est possible de déterminer la constante d’équilibre d’une réaction chimique à partir de données thermiques et, ce faisant, il a formulé ce qu’il a lui-même appelé la troisième loi de la thermodynamique. Cela indique que l’entropie (une mesure thermodynamique du désordre dans un système) s’approche de zéro lorsque la température se rapproche du zéro absolu. Pour cela, il a reçu le prix Nobel de chimie en 1920. En 1918, il a expliqué l’explosion de H2-Cl2 lors de l’exposition à la lumière comme une réaction en chaîne atomique.
https://www.uni-wuerzburg.de/en/uniarchiv/personalities/eminent-scholars/walther-hermann-nernst/
https://www.chemeurope.com/en/encyclopedia/Walther_Nernst.html
https://www.nobelprize.org/prizes/chemistry/1920/nernst/biographical/

