L’ADN les séquences de l’innovation
L’ADN les séquences de l’innovation Cette technologie peut dévoiler tout ce qui se cache sous terre
Cette technologie peut dévoiler tout ce qui se cache sous terre Projet du génome humain
Projet du génome humain .png) Deux jours, à peine : c’est le temps qu’il faut désormais à une machine de haute technologie pour lire les trois milliards de caractères d’un génome humain. À Lyon, la révolution du séquençage ADN est en marche contre les maladies rares. Le premier décryptage d’un génome complet, en 2003, avait nécessité plus d’une décennie de travaux internationaux et quelque trois milliards de dollars d’investissement. Délais et coûts ont fondu depuis.
Deux jours, à peine : c’est le temps qu’il faut désormais à une machine de haute technologie pour lire les trois milliards de caractères d’un génome humain. À Lyon, la révolution du séquençage ADN est en marche contre les maladies rares. Le premier décryptage d’un génome complet, en 2003, avait nécessité plus d’une décennie de travaux internationaux et quelque trois milliards de dollars d’investissement. Délais et coûts ont fondu depuis. « On a lancé ce matin 160 séquençages, qui prendront moins de deux jours », indique Damien Sanlaville, chef du service de génétique aux Hospices Civils de Lyon (HCL, 2e centre hospitalier universitaire français), devant les machines du laboratoire régional Auragen, en service depuis fin 2019. C’est l’une des deux entités créées dans le cadre du plan « France Médecine Génomique 2025 » – l’autre portée par les hôpitaux parisiens. Près de 8.000 ont été répertoriées et elles concernent environ trois millions de personnes en France, dont une grande majorité d’enfants. Leur prévalence est faible : une maladie est dite « rare » quand elle touche moins d’un individu sur 2.000.
« On a lancé ce matin 160 séquençages, qui prendront moins de deux jours », indique Damien Sanlaville, chef du service de génétique aux Hospices Civils de Lyon (HCL, 2e centre hospitalier universitaire français), devant les machines du laboratoire régional Auragen, en service depuis fin 2019. C’est l’une des deux entités créées dans le cadre du plan « France Médecine Génomique 2025 » – l’autre portée par les hôpitaux parisiens. Près de 8.000 ont été répertoriées et elles concernent environ trois millions de personnes en France, dont une grande majorité d’enfants. Leur prévalence est faible : une maladie est dite « rare » quand elle touche moins d’un individu sur 2.000. Cette rareté engendre souvent une errance diagnostique, parfois durant plusieurs années : « pour lutter, encore faut-il savoir quel est l’ennemi », souligne M. Sanlaville. Or, 80% de ces pathologies ont une origine génétique : d’où l’intérêt de pouvoir déchiffrer rapidement un ADN pour en déceler les éventuelles anomalies, en lien avec une plateforme régionale d’expertise médicale (Lyon et quatre autres villes). L’accès au séquençage est soumis aux pré-indications de la Haute Autorité de Santé, soit 63 pathologies au 1er mars. Avec l’objectif de déchiffrer à Lyon comme à Paris, 18.000 génomes par an d’ici à 2025. – Passe-plats – À l’hôpital Édouard-Herriot à Lyon, le séquençage à haut débit est assuré par quatre machines NovaSeq 6000 de l’entreprise américaine Illumina, à un million d’euros pièce. Ces gros cubes blancs, qui pèsent une tonne mais ne bourdonnent guère plus qu’un appareil électro-ménager, tournent six jours sur sept, par cycles de 44 heures, pour lire les trois milliards de « paires de bases » composant l’ADN d’un individu. « Le génome, c’est un grand livre dont les chapitres seraient les chromosomes, les gènes les paragraphes, et les phrases une succession de lettres », compare Christine Vinciguerra, directrice médicale d’Auragen. Soit A, T, G et C, initiales des quatre bases azotées de l’alphabet biologique : Adénine, Thymine, Guanine et Cytosine.
Cette rareté engendre souvent une errance diagnostique, parfois durant plusieurs années : « pour lutter, encore faut-il savoir quel est l’ennemi », souligne M. Sanlaville. Or, 80% de ces pathologies ont une origine génétique : d’où l’intérêt de pouvoir déchiffrer rapidement un ADN pour en déceler les éventuelles anomalies, en lien avec une plateforme régionale d’expertise médicale (Lyon et quatre autres villes). L’accès au séquençage est soumis aux pré-indications de la Haute Autorité de Santé, soit 63 pathologies au 1er mars. Avec l’objectif de déchiffrer à Lyon comme à Paris, 18.000 génomes par an d’ici à 2025. – Passe-plats – À l’hôpital Édouard-Herriot à Lyon, le séquençage à haut débit est assuré par quatre machines NovaSeq 6000 de l’entreprise américaine Illumina, à un million d’euros pièce. Ces gros cubes blancs, qui pèsent une tonne mais ne bourdonnent guère plus qu’un appareil électro-ménager, tournent six jours sur sept, par cycles de 44 heures, pour lire les trois milliards de « paires de bases » composant l’ADN d’un individu. « Le génome, c’est un grand livre dont les chapitres seraient les chromosomes, les gènes les paragraphes, et les phrases une succession de lettres », compare Christine Vinciguerra, directrice médicale d’Auragen. Soit A, T, G et C, initiales des quatre bases azotées de l’alphabet biologique : Adénine, Thymine, Guanine et Cytosine. Le laboratoire Auragen est organisé en circuit fermé autour d’un système de « passe-plats » hermétiques entre les pièces, afin d’éviter toute contamination des échantillons sanguins durant leur préparation. Ici tout est automatisé, ou presque, de l’extraction de l’ADN au travail des séquenceurs. Ceux-ci répètent leur opération de lecture 30 fois, pour être le plus précis possible ; les données brutes sont ensuite traitées à Grenoble (à une centaine de kilomètres de Lyon) par des bio-informaticiens, afin de permettre leur analyse génétique, puis une interprétation biologique et clinique. Un travail de quatre à six mois, au terme duquel des solutions thérapeutiques peuvent être proposées au patient.
Le laboratoire Auragen est organisé en circuit fermé autour d’un système de « passe-plats » hermétiques entre les pièces, afin d’éviter toute contamination des échantillons sanguins durant leur préparation. Ici tout est automatisé, ou presque, de l’extraction de l’ADN au travail des séquenceurs. Ceux-ci répètent leur opération de lecture 30 fois, pour être le plus précis possible ; les données brutes sont ensuite traitées à Grenoble (à une centaine de kilomètres de Lyon) par des bio-informaticiens, afin de permettre leur analyse génétique, puis une interprétation biologique et clinique. Un travail de quatre à six mois, au terme duquel des solutions thérapeutiques peuvent être proposées au patient.
 Un gradiomètre de gravité quantique – Une quantité d’applications dans divers domaines
Un gradiomètre de gravité quantique – Une quantité d’applications dans divers domaines 
Des chercheurs sont parvenus à localiser un tunnel sous un mètre de terre. Grâce à un gradiomètre de gravité quantique. Une technologie qui se montre, pour la première fois, capable de sortir du laboratoire et de se frotter aux réalités du terrain. Drôle de terme. Pour un drôle d’engin. Un gradiomètre, c’est un appareil destiné à mesurer dans l’espace, le gradient d’une grandeur physique. Un gradiomètre de gravité mesure donc les variations de la gravité. Et dans le cas d’un gradiomètre de gravité quantique, la mesure se fait en exploitant les principes de la physique quantique. Grâce à un capteur qui mesure les changements de gravité lorsqu’un nuage d’atomes tombe. Les vibrations, l’inclinaison des instruments et les perturbations causées par les champs magnétiques et thermiques extérieurs ont longtemps confiné la technologie au laboratoire. Mais aujourd’hui, des chercheurs de l’université de Birmingham (Royaume-Uni) annoncent être parvenus à atténuer ces différents bruits et avoir trouvé au gradiomètre de gravité quantique une application pratique. Avec son aide, ils ont détecté un tunnel enterré à un mètre sous la surface en mesurant des variations de microgravité.
Drôle de terme. Pour un drôle d’engin. Un gradiomètre, c’est un appareil destiné à mesurer dans l’espace, le gradient d’une grandeur physique. Un gradiomètre de gravité mesure donc les variations de la gravité. Et dans le cas d’un gradiomètre de gravité quantique, la mesure se fait en exploitant les principes de la physique quantique. Grâce à un capteur qui mesure les changements de gravité lorsqu’un nuage d’atomes tombe. Les vibrations, l’inclinaison des instruments et les perturbations causées par les champs magnétiques et thermiques extérieurs ont longtemps confiné la technologie au laboratoire. Mais aujourd’hui, des chercheurs de l’université de Birmingham (Royaume-Uni) annoncent être parvenus à atténuer ces différents bruits et avoir trouvé au gradiomètre de gravité quantique une application pratique. Avec son aide, ils ont détecté un tunnel enterré à un mètre sous la surface en mesurant des variations de microgravité. Les chercheurs estiment que leur gradiomètre de gravité quantique permettra à l’avenir de réaliser des relevés moins coûteux et dix fois plus rapidement qu’avec les capteurs classiques. Le tout avec une précision et une fiabilité accrues. Les applications envisagées sont nombreuses. Des applications de défense et de sécurité, par exemple. Puisque de telles mesures de microgravité pourraient permettre de révéler l’indétectable et ainsi, de se déplacer sereinement, y compris dans des environnements difficiles. Le gradiomètre de gravité quantique pourrait aussi révolutionner notre façon de concevoir, de construire et d’entretenir nos logements et nos infrastructures. Il pourrait aider à identifier des ressources naturelles — ou des structures bâties cachées sous terre — ou même, améliorer la prédiction des phénomènes de type éruptions volcaniques.
Les chercheurs estiment que leur gradiomètre de gravité quantique permettra à l’avenir de réaliser des relevés moins coûteux et dix fois plus rapidement qu’avec les capteurs classiques. Le tout avec une précision et une fiabilité accrues. Les applications envisagées sont nombreuses. Des applications de défense et de sécurité, par exemple. Puisque de telles mesures de microgravité pourraient permettre de révéler l’indétectable et ainsi, de se déplacer sereinement, y compris dans des environnements difficiles. Le gradiomètre de gravité quantique pourrait aussi révolutionner notre façon de concevoir, de construire et d’entretenir nos logements et nos infrastructures. Il pourrait aider à identifier des ressources naturelles — ou des structures bâties cachées sous terre — ou même, améliorer la prédiction des phénomènes de type éruptions volcaniques.Projet du génome humain
La plus importante entreprise de recherche biomédicale du XXe siècle
La grande image
- Le projet du génome humain était un effort scientifique mondial historique dont l’objectif principal était de générer la première séquence du génome humain.
- En 2003, le Human Genome Project a produit une séquence du génome représentant plus de 90 % du génome humain. Il était aussi près d’être achevé que les technologies de séquençage de l’ADN le permettaient à l’époque.
- Le projet était essentiel pour faire avancer les politiques et obtenir un soutien accru pour le partage ouvert des données scientifiques.
- Les préoccupations et les questions concernant le séquençage du génome humain ont contribué à mettre davantage l’accent sur l’éthique dans la recherche biomédicale.
- Le projet était atypique pour la recherche biomédicale, en ce sens que le travail des chercheurs était motivé par le désir d’explorer une partie inconnue du monde biologique, plutôt que de formuler d’abord une théorie ou une hypothèse.
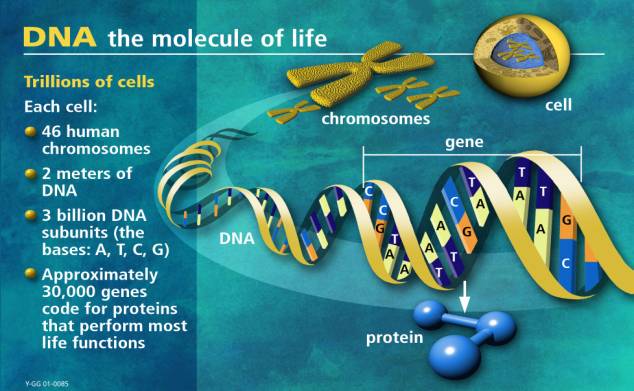 Qu’est-ce que le projet du génome humain ? Le projet du génome humain était un effort international important, bien organisé et hautement collaboratif qui a généré la première séquence du génome humain et celle de plusieurs autres organismes bien étudiés. Mené de 1990 à 2003, ce fut l’une des entreprises scientifiques les plus ambitieuses et les plus importantes de l’histoire de l’humanité.
Qu’est-ce que le projet du génome humain ? Le projet du génome humain était un effort international important, bien organisé et hautement collaboratif qui a généré la première séquence du génome humain et celle de plusieurs autres organismes bien étudiés. Mené de 1990 à 2003, ce fut l’une des entreprises scientifiques les plus ambitieuses et les plus importantes de l’histoire de l’humanité.
Quels étaient les objectifs du projet du génome humain ? Un comité spécial de l’Académie nationale des sciences des États-Unis a défini les objectifs initiaux du projet du génome humain en 1988, qui comprenait le séquençage de l’ensemble du génome humain en plus des génomes de plusieurs organismes non humains soigneusement sélectionnés.
Un comité spécial de l’Académie nationale des sciences des États-Unis a défini les objectifs initiaux du projet du génome humain en 1988, qui comprenait le séquençage de l’ensemble du génome humain en plus des génomes de plusieurs organismes non humains soigneusement sélectionnés.
Finalement, la liste des organismes en vint à inclure la bactérie E. coli , la levure de boulanger, la mouche des fruits, le nématode et la souris. Les architectes et les participants du projet espéraient que les informations résultantes inaugureraient une nouvelle ère pour la recherche biomédicale, et ses objectifs et plans stratégiques connexes ont été mis à jour périodiquement tout au long du projet. En partie en raison d’une concentration délibérée sur le développement technologique, le projet du génome humain a finalement dépassé son ensemble d’objectifs initiaux, le faisant en 2003, deux ans avant son achèvement initialement prévu en 2005. De nombreuses réalisations du projet dépassaient ce que les scientifiques pensaient possible en 1988.
En partie en raison d’une concentration délibérée sur le développement technologique, le projet du génome humain a finalement dépassé son ensemble d’objectifs initiaux, le faisant en 2003, deux ans avant son achèvement initialement prévu en 2005. De nombreuses réalisations du projet dépassaient ce que les scientifiques pensaient possible en 1988. Qu’est-ce que le séquençage de l’ADN ? Comment a-t-il été exécuté pendant le projet du génome humain ?
Qu’est-ce que le séquençage de l’ADN ? Comment a-t-il été exécuté pendant le projet du génome humain ?
Le séquençage de l’ADN consiste à déterminer l’ordre exact des bases de l’ADN – les As, Cs, Gs et Ts qui composent les segments de l’ADN. Étant donné que le projet du génome humain visait à séquencer tout l’ADN (c’est-à-dire le génome) d’un ensemble d’organismes, des efforts importants ont été déployés pour améliorer les méthodes de séquençage de l’ADN. En fin de compte, le projet a utilisé une méthode particulière pour le séquençage de l’ADN, appelée séquençage de l’ADN Sanger, mais a d’abord considérablement fait progresser cette méthode de base grâce à une série d’innovations techniques majeures. Quel ADN a été séquencé par le projet du génome humain ? Comment a-t-il été collecté ?
Quel ADN a été séquencé par le projet du génome humain ? Comment a-t-il été collecté ?
La séquence du génome humain générée par le projet du génome humain ne provenait pas d’une seule personne. Au contraire, cela reflète un patchwork de plusieurs personnes dont les identités ont été intentionnellement rendues anonymes pour protéger leur vie privée. Les chercheurs du projet ont utilisé un processus réfléchi pour recruter des volontaires, obtenir leur consentement éclairé et prélever leurs échantillons de sang. La majeure partie de la séquence du génome humain générée par le projet du génome humain provenait de donneurs de sang à Buffalo, New York ; plus précisément, 93 % de 11 donneurs et 70 % d’un donneur.
Les chercheurs du projet ont utilisé un processus réfléchi pour recruter des volontaires, obtenir leur consentement éclairé et prélever leurs échantillons de sang. La majeure partie de la séquence du génome humain générée par le projet du génome humain provenait de donneurs de sang à Buffalo, New York ; plus précisément, 93 % de 11 donneurs et 70 % d’un donneur.
Qui a réalisé le projet du génome humain ?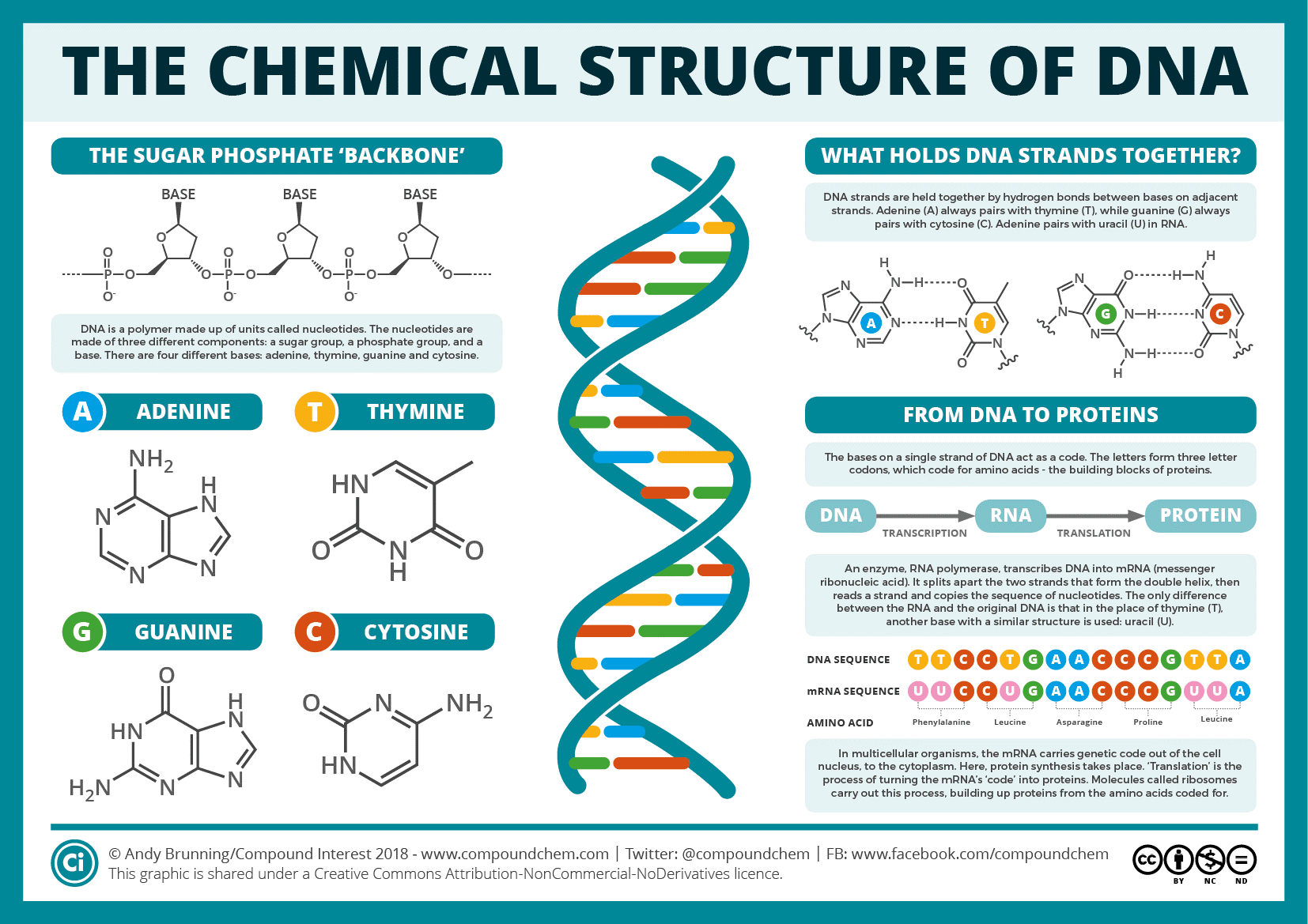 Le projet du génome humain n’aurait pas pu être réalisé aussi rapidement et efficacement sans la participation dévouée d’un consortium international de milliers de chercheurs. Aux États-Unis, les chercheurs ont été financés par le Department of Energy et les National Institutes of Health, qui ont créé l’Office for Human Genome Research en 1988 (rebaptisé plus tard National Center for Human Genome Research en 1990 puis National Human Genome Research Institut en 1997).
Le projet du génome humain n’aurait pas pu être réalisé aussi rapidement et efficacement sans la participation dévouée d’un consortium international de milliers de chercheurs. Aux États-Unis, les chercheurs ont été financés par le Department of Energy et les National Institutes of Health, qui ont créé l’Office for Human Genome Research en 1988 (rebaptisé plus tard National Center for Human Genome Research en 1990 puis National Human Genome Research Institut en 1997).
Le séquençage du génome humain a impliqué des chercheurs de 20 universités et centres de recherche distincts aux États-Unis, au Royaume-Uni, en France, en Allemagne, au Japon et en Chine. Les groupes de ces pays sont devenus connus sous le nom de Consortium international de séquençage du génome humain.
Combien a coûté le projet du génome humain ? Le coût initialement prévu pour le projet du génome humain était de 3 milliards de dollars, sur la base de sa durée envisagée de 15 ans. Bien qu’une comptabilisation précise des coûts ait été difficile à réaliser, en particulier pour l’ensemble des bailleurs de fonds internationaux, la plupart s’accordent à dire que ce montant approximatif est proche du chiffre exact.
Le coût initialement prévu pour le projet du génome humain était de 3 milliards de dollars, sur la base de sa durée envisagée de 15 ans. Bien qu’une comptabilisation précise des coûts ait été difficile à réaliser, en particulier pour l’ensemble des bailleurs de fonds internationaux, la plupart s’accordent à dire que ce montant approximatif est proche du chiffre exact.
Le coût du projet du génome humain, bien que se chiffrant en milliards de dollars, a été largement compensé par les avantages économiques positifs que la génomique a apportés au cours des décennies suivantes. Ces gains économiques reflètent des liens directs entre les produits qui en résultent et les progrès des industries pharmaceutiques et biotechnologiques, entre autres.
Le projet du génome humain a-t-il produit une séquence du génome parfaitement complète ?
Non. Tout au long du projet du génome humain, les chercheurs ont continuellement amélioré les méthodes de séquençage de l’ADN. Cependant, ils étaient limités dans leurs capacités à déterminer la séquence de certains tronçons d’ADN humain (par exemple, ADN particulièrement complexe ou hautement répétitif). En juin 2000, le Consortium international de séquençage du génome humain a annoncé qu’il avait produit un projet de séquence du génome humain représentant 90 % du génome humain. Le projet de séquence contenait plus de 150 000 zones où la séquence d’ADN était inconnue car elle ne pouvait pas être déterminée avec précision (appelées lacunes).
En juin 2000, le Consortium international de séquençage du génome humain a annoncé qu’il avait produit un projet de séquence du génome humain représentant 90 % du génome humain. Le projet de séquence contenait plus de 150 000 zones où la séquence d’ADN était inconnue car elle ne pouvait pas être déterminée avec précision (appelées lacunes).
En avril 2003, le consortium a annoncé qu’il avait généré une séquence du génome humain essentiellement complète, qui a été considérablement améliorée par rapport au projet de séquence. Plus précisément, il représentait 92 % du génome humain et moins de 400 lacunes ; c’était aussi plus précis. Le 31 mars 2022, le consortium Telomere-to-Telomer (T2T) a annoncé qu’il avait comblé les lacunes restantes et produit la première séquence véritablement complète du génome humain.
Le 31 mars 2022, le consortium Telomere-to-Telomer (T2T) a annoncé qu’il avait comblé les lacunes restantes et produit la première séquence véritablement complète du génome humain.
Comment le projet du génome humain a-t-il changé les pratiques en matière de partage de données dans la communauté de la recherche scientifique ?
Les scientifiques du projet du génome humain ont rendu chaque partie du projet de séquence du génome humain accessible au public peu de temps après la production.
Cette routine est issue de deux réunions aux Bermudes au cours desquelles les chercheurs du projet ont accepté les « principes des Bermudes », qui énoncent les règles de diffusion rapide des données de séquence. Cet accord historique a été crédité d’avoir établi une plus grande sensibilisation et ouverture au partage de données dans la recherche biomédicale, ce qui en fait l’un des héritages les plus importants du projet du génome humain.
Comment le projet du génome humain a-t-il favorisé l’éthique dans la recherche biologique ?
Les dirigeants du projet du génome humain ont reconnu la nécessité d’être proactifs dans la résolution d’un large éventail de problèmes éthiques et sociaux liés à l’acquisition et à l’utilisation de l’information génomique. Ils étaient particulièrement conscients des risques et avantages potentiels de l’intégration des nouvelles connaissances génomiques dans la recherche et la médecine. De même, ils étaient conscients de l’utilisation abusive potentielle des informations génomiques en matière d’assurance et d’emploi, entre autres.
Pour aider à comprendre et à résoudre ces problèmes, le NHGRI a créé le programme de recherche sur les implications éthiques, juridiques et sociales (ELSI) en 1990.
L’appréciation précoce de la valeur de ce programme a conduit plus tard le Congrès américain à exiger que le NHGRI consacre au moins 5% de son budget de recherche à l’étude des implications éthiques, juridiques et sociales des avancées génomiques. Le programme de recherche NHGRI ELSI est devenu un modèle pour la recherche en bioéthique dans le monde entier.
Comment le projet du génome humain a-t-il affecté la recherche biologique en général ? Le projet du génome humain a démontré que la recherche scientifique axée sur la production et la découverte – qui n’impliquait pas l’examen d’une hypothèse spécifique ou la réponse directe à des questions préformées – pouvait être remarquablement précieuse et bénéfique pour la communauté scientifique au sens large.
Le projet du génome humain a démontré que la recherche scientifique axée sur la production et la découverte – qui n’impliquait pas l’examen d’une hypothèse spécifique ou la réponse directe à des questions préformées – pouvait être remarquablement précieuse et bénéfique pour la communauté scientifique au sens large.
Le projet a également été un exemple réussi de « big science » dans la recherche biomédicale. L’ampleur des défis technologiques a incité le projet du génome humain à réunir des groupes interdisciplinaires du monde entier, impliquant des experts en ingénierie, en biologie et en informatique, entre autres domaines. Il fallait aussi que les travaux soient concentrés dans un petit nombre de grands centres pour maximiser les économies d’échelle.
Avant le projet du génome humain, la communauté de la recherche biomédicale considérait les projets d’une telle envergure avec un profond scepticisme. Ces types d’entreprises scientifiques massives sont devenues plus courantes et bien acceptées, en partie grâce au succès du projet du génome humain. Des scientifiques cultivent des embryons « synthétiques » avec un cerveau et un cœur battant – sans œufs ni sperme
Des scientifiques cultivent des embryons « synthétiques » avec un cerveau et un cœur battant – sans œufs ni sperme
Des scientifiques de l’Université de Cambridge ont créé des embryons modèles à partir de cellules souches de souris qui forment un cerveau, un cœur battant et les fondations de tous les autres organes du corps. Il représente une nouvelle avenue pour recréer les premières étapes de la vie. L’équipe de chercheurs, dirigée par la professeure Magdalena Zernicka-Goetz, a développé le modèle d’embryon sans ovule ni sperme. Au lieu de cela, ils ont utilisé des cellules souches – les cellules maîtresses du corps, qui peuvent se développer en presque n’importe quel type de cellule dans le corps.
« C’est tout simplement incroyable que nous soyons rendus aussi loin. C’est le rêve de notre communauté depuis des années, et l’objectif principal de notre travail depuis une décennie et finalement nous l’avons fait. — Madeleine Zernicka-Goetz En guidant les trois types de cellules souches trouvées au début du développement des mammifères jusqu’au point où elles commencent à interagir, les chercheurs ont imité les processus naturels en laboratoire. Les scientifiques ont réussi à faire « parler » les cellules souches en induisant l’expression d’un ensemble particulier de gènes et en établissant un environnement unique pour leurs interactions.
En guidant les trois types de cellules souches trouvées au début du développement des mammifères jusqu’au point où elles commencent à interagir, les chercheurs ont imité les processus naturels en laboratoire. Les scientifiques ont réussi à faire « parler » les cellules souches en induisant l’expression d’un ensemble particulier de gènes et en établissant un environnement unique pour leurs interactions.
Les cellules souches se sont auto-organisées en structures qui ont progressé à travers les stades de développement successifs jusqu’à ce qu’elles aient des cœurs battants et les fondations du cerveau. Elles avaient également le sac vitellin où l’embryon se développe et puise ses nutriments au cours de ses premières semaines. Contrairement à d’autres embryons synthétiques, les modèles développés par Cambridge ont atteint le point où tout le cerveau, y compris la partie antérieure, a commencé à se développer. Il s’agit d’un stade de développement supérieur à celui atteint dans tout autre modèle dérivé de cellules souches.
Selon l’équipe, leurs résultats pourraient aider les chercheurs à comprendre pourquoi certains embryons échouent tandis que d’autres continuent à se développer en une grossesse saine. De plus, les résultats pourraient être utilisés pour guider la réparation et le développement d’organes humains synthétiques destinés à la transplantation. L’étude, qui est le résultat de plus d’une décennie de recherche qui a progressivement conduit à des structures embryonnaires de plus en plus complexes, a été rapportée le 25 août 2022 dans la revue Nature .
« Notre modèle d’embryon de souris développe non seulement un cerveau, mais aussi un cœur qui bat, tous les composants qui composent le corps », a déclaré Zernicka-Goetz, professeur de développement des mammifères et de biologie des cellules souches au département de physiologie du développement de Cambridge. et Neurosciences. « C’est tout simplement incroyable que nous soyons rendus aussi loin. C’est le rêve de notre communauté depuis des années, et l’objectif principal de notre travail depuis une décennie et finalement nous l’avons fait. Un « dialogue » entre les tissus qui formeront l’embryon et les tissus qui relieront l’embryon à la mère est nécessaire au bon développement d’un embryon humain. Trois différents types de cellules souches commencent à se former au cours de la première semaine suivant la fécondation ; l’un d’eux finira par se développer dans les tissus corporels, tandis que les deux autres soutiennent le développement de l’embryon. L’un de ces types de cellules souches extra-embryonnaires deviendra le placenta, qui relie le fœtus à la mère et fournit de l’oxygène et des nutriments. Le second est le sac vitellin, où l’embryon se développe et d’où il tire ses nutriments au début du développement.
Un « dialogue » entre les tissus qui formeront l’embryon et les tissus qui relieront l’embryon à la mère est nécessaire au bon développement d’un embryon humain. Trois différents types de cellules souches commencent à se former au cours de la première semaine suivant la fécondation ; l’un d’eux finira par se développer dans les tissus corporels, tandis que les deux autres soutiennent le développement de l’embryon. L’un de ces types de cellules souches extra-embryonnaires deviendra le placenta, qui relie le fœtus à la mère et fournit de l’oxygène et des nutriments. Le second est le sac vitellin, où l’embryon se développe et d’où il tire ses nutriments au début du développement.
De nombreuses grossesses échouent au moment où les trois types de cellules souches commencent à s’envoyer des signaux mécaniques et chimiques, qui indiquent à l’embryon comment se développer correctement.
Le groupe du professeur Zernicka-Goetz à Cambridge a étudié ces premiers stades de la grossesse au cours de la dernière décennie, afin de comprendre pourquoi certaines grossesses échouent et d’autres réussissent.
« Le modèle d’embryon de cellules souches est important car il nous donne accès à la structure en développement à un stade qui nous est normalement caché en raison de l’implantation du petit embryon dans l’utérus de la mère », a déclaré Zernicka-Goetz. « Cette accessibilité nous permet de manipuler les gènes pour comprendre leurs rôles de développement dans un système expérimental modèle. »
Pour guider le développement de leur embryon synthétique, les scientifiques ont assemblé des cellules souches cultivées représentant chacun des trois types de tissus dans les bonnes proportions et l’environnement pour favoriser leur croissance et leur communication les unes avec les autres, pour finalement s’auto-assembler en un embryon.
L’équipe de recherche a découvert que les cellules extra-embryonnaires envoient des signaux aux cellules embryonnaires par des signaux chimiques mais aussi de manière mécanique, ou par le toucher, guidant le développement de l’embryon.
« Cette période de la vie humaine est si mystérieuse, alors pouvoir voir comment cela se passe dans un plat – avoir accès à ces cellules souches individuelles, comprendre pourquoi tant de grossesses échouent et comment nous pourrions être en mesure d’empêcher que cela se produise. – est assez spécial », a déclaré Zernicka-Goetz. « Nous avons examiné le dialogue qui doit se produire entre les différents types de cellules souches à ce moment-là – nous avons montré comment cela se produit et comment cela peut mal tourner. »
Une avancée majeure dans l’étude est la capacité à générer l’ensemble du cerveau, en particulier la partie antérieure, qui a été un objectif majeur dans le développement d’embryons synthétiques. Cela fonctionne dans le système de Zernicka-Goetz car cette partie du cerveau a besoin de signaux provenant de l’un des tissus extra-embryonnaires pour pouvoir se développer. L’équipe a pensé que cela pourrait se produire à partir de leurs études de 2018 et 2021, qui utilisaient les mêmes cellules constitutives pour se développer en embryons à un stade légèrement plus précoce. Maintenant, en poussant le développement un jour plus loin, ils peuvent définitivement dire que leur modèle est le tout premier à signaler le développement du cerveau antérieur, et en fait de tout le cerveau.
« Cela ouvre de nouvelles possibilités pour étudier les mécanismes du développement neurologique dans un modèle expérimental », a déclaré Zernicka-Goetz. « En fait, nous démontrons la preuve de ce principe dans l’article en supprimant un gène déjà connu pour être essentiel à la formation du tube neural, précurseur du système nerveux, et au développement du cerveau et des yeux. En l’absence de ce gène, les embryons synthétiques présentent exactement les défauts connus du développement cérébral comme chez un animal porteur de cette mutation. Cela signifie que nous pouvons commencer à appliquer ce type d’approche aux nombreux gènes dont la fonction est inconnue dans le développement du cerveau.
Alors que la recherche actuelle a été menée sur des modèles de souris, les chercheurs développent des modèles humains similaires avec le potentiel d’être orientés vers la génération de types d’organes spécifiques pour comprendre les mécanismes derrière des processus cruciaux qui seraient autrement impossibles à étudier dans de vrais embryons. À l’heure actuelle, la loi britannique n’autorise l’étude en laboratoire des embryons humains que jusqu’au 14 e jour de développement.
Si les méthodes développées par l’équipe de Zernicka-Goetz s’avèrent efficaces avec les cellules souches humaines à l’avenir, elles pourraient également être utilisées pour guider le développement d’organes synthétiques pour les patients en attente de greffe.
« Il y a tellement de gens dans le monde qui attendent des années pour des greffes d’organes », a déclaré Zernicka-Goetz. « Ce qui rend notre travail si passionnant, c’est que les connaissances qui en découlent pourraient être utilisées pour développer des organes humains synthétiques corrects afin de sauver des vies qui sont actuellement perdues. Il devrait également être possible d’affecter et de guérir les organes adultes en utilisant les connaissances que nous avons sur la façon dont ils sont fabriqués. « C’est un pas en avant incroyable qui a nécessité 10 ans de travail acharné de la part de plusieurs membres de mon équipe. Je n’aurais jamais pensé que nous en arriverions là. Vous ne pensez jamais que vos rêves se réaliseront, mais ils l’ont fait.
« C’est un pas en avant incroyable qui a nécessité 10 ans de travail acharné de la part de plusieurs membres de mon équipe. Je n’aurais jamais pensé que nous en arriverions là. Vous ne pensez jamais que vos rêves se réaliseront, mais ils l’ont fait.
La professeure Magdalena Zernicka-Goetz a fait une incroyable percée scientifique. La création d’embryons synthétiques de souris dans un tube à essai qui développent des cerveaux et des cœurs battants, en commençant uniquement par des cellules souches embryonnaires, est l’aboutissement d’une décennie de travail.
La création d’embryons synthétiques de souris dans un tube à essai qui développent des cerveaux et des cœurs battants, en commençant uniquement par des cellules souches embryonnaires, est l’aboutissement d’une décennie de travail.
Je suis fasciné par le mystère du fonctionnement des embryons. Chaque embryon suit un parcours similaire : une cellule devient multiple, puis elles communiquent entre elles et s’arrangent pour former une structure qui fournira un schéma directeur pour toutes les parties du corps adulte. Mais comment les cellules embryonnaires décident-elles de leur sort, comment savent-elles où aller et quoi faire ? Comment forment-ils les bonnes pièces au bon endroit au bon moment ? La construction des premiers modèles « d’embryons synthétiques » a été un processus que nous avons réalisé étape par étape. Au départ, nous savions que les cellules souches embryonnaires pouvaient être cultivées indéfiniment en laboratoire, et que lorsqu’elles sont injectées dans un embryon, elles peuvent potentiellement contribuer à n’importe quel tissu de l’organisme adulte. Le défi consistait à les guider pour qu’ils se développent en un embryon complet. En plus des cellules souches embryonnaires, nous avons utilisé deux types de tissus extra-embryonnaires : l’un forme le placenta et l’autre un sac dans lequel se développe l’embryon. Ces tissus sont très importants, car ils envoient des signaux à l’embryon pour qu’il développe toutes ses parties au bon moment et au bon endroit.
La construction des premiers modèles « d’embryons synthétiques » a été un processus que nous avons réalisé étape par étape. Au départ, nous savions que les cellules souches embryonnaires pouvaient être cultivées indéfiniment en laboratoire, et que lorsqu’elles sont injectées dans un embryon, elles peuvent potentiellement contribuer à n’importe quel tissu de l’organisme adulte. Le défi consistait à les guider pour qu’ils se développent en un embryon complet. En plus des cellules souches embryonnaires, nous avons utilisé deux types de tissus extra-embryonnaires : l’un forme le placenta et l’autre un sac dans lequel se développe l’embryon. Ces tissus sont très importants, car ils envoient des signaux à l’embryon pour qu’il développe toutes ses parties au bon moment et au bon endroit. Combiner des cellules souches représentant chacun de ces trois types de tissus est plus facile à dire qu’à faire. Nous devions trouver un environnement où les trois types cellulaires distincts pouvaient se développer et communiquer entre eux. Et nous devions trouver les bonnes proportions de chaque type de cellule, et les ajouter dans le bon ordre. Une fois ces principes de base établis, les cellules souches ont fait le reste : elles se sont auto-organisées pour progresser à travers des étapes de développement successives jusqu’à ce qu’elles aient un cœur battant et les fondations d’un cerveau.
Combiner des cellules souches représentant chacun de ces trois types de tissus est plus facile à dire qu’à faire. Nous devions trouver un environnement où les trois types cellulaires distincts pouvaient se développer et communiquer entre eux. Et nous devions trouver les bonnes proportions de chaque type de cellule, et les ajouter dans le bon ordre. Une fois ces principes de base établis, les cellules souches ont fait le reste : elles se sont auto-organisées pour progresser à travers des étapes de développement successives jusqu’à ce qu’elles aient un cœur battant et les fondations d’un cerveau.
La clé de notre réussite a été de sortir des sentiers battus. La majorité des études sur les modèles d’embryons se concentrent sur les cellules souches embryonnaires, mais ne tiennent pas compte du rôle important des cellules extra-embryonnaires. Nous avons mélangé les bonnes proportions de cellules souches embryonnaires et extra-embryonnaires. Les cellules extra-embryonnaires envoient des signaux aux cellules embryonnaires par différents moyens, par des signaux chimiques mais aussi de manière mécanique « par le toucher ». Nos études aident à comprendre ces événements de signalisation. Nous développons un modèle analogue de l’embryon humain, pour comprendre les mécanismes derrière des processus cruciaux qui seraient autrement impossibles à étudier. Ceci est important car la grande majorité des grossesses humaines échouent à ce stade de développement, en raison de causes que nous ne comprenons pas. Elle permettra également d’identifier les facteurs permettant le développement de tissus humains sains au fur et à mesure qu’ils forment différents organes.
Nous développons un modèle analogue de l’embryon humain, pour comprendre les mécanismes derrière des processus cruciaux qui seraient autrement impossibles à étudier. Ceci est important car la grande majorité des grossesses humaines échouent à ce stade de développement, en raison de causes que nous ne comprenons pas. Elle permettra également d’identifier les facteurs permettant le développement de tissus humains sains au fur et à mesure qu’ils forment différents organes.
La création du nouvel « embryon synthétique » nous a beaucoup appris sur les mécanismes par lesquels l’embryon se construit. Nous avons appris comment les tissus extra-embryonnaires dirigent les cellules souches embryonnaires le long des bonnes voies pour signaler la formation des structures correctes ; comment les cellules se déplacent entre les compartiments à mesure que le plan corporel multicouche apparaît ; et comment cela prépare correctement le terrain pour la neurulation – le processus par lequel les tissus se plient pour former le tube neural et, à son tour, le cerveau et la moelle épinière. Ce modèle nous donne accès à la structure en développement à un stade qui nous est normalement caché, lorsque le petit embryon s’implante dans le ventre de la mère. Notre modèle n’a pas besoin d’implanter pour se développer, il reste donc complètement visible pour nous, ce qui nous permet de voir la progression de l’embryon à travers ce stade de développement. Cette accessibilité nous permet de manipuler les gènes pour comprendre leurs rôles développementaux dans un système expérimental modèle.
Ce modèle nous donne accès à la structure en développement à un stade qui nous est normalement caché, lorsque le petit embryon s’implante dans le ventre de la mère. Notre modèle n’a pas besoin d’implanter pour se développer, il reste donc complètement visible pour nous, ce qui nous permet de voir la progression de l’embryon à travers ce stade de développement. Cette accessibilité nous permet de manipuler les gènes pour comprendre leurs rôles développementaux dans un système expérimental modèle.
Il est certain que la réalisation de ce type de travail demande passion et résilience. J’ai grandi en Pologne sous un régime communiste, ce qui signifiait que voyager n’était pas autorisé et penser différemment n’était pas encouragé. Il y avait une immense pression sociale pour se conformer, et beaucoup d’entre nous se sont rebellés contre cela. Une doublure argentée de ceci était un désir de penser de manière indépendante et de persévérer malgré le découragement. Cela m’a également façonné en tant que scientifique. Lorsque j’ai lancé mon groupe de recherche à Cambridge, j’ai mis en place des moyens d’étudier la «boîte noire du développement» – le développement de l’embryon au moment de l’implantation. Mes mentors m’avaient découragé de le poursuivre pendant mon doctorat parce qu’ils craignaient qu’il soit difficile de faire la lumière à l’intérieur de cette « boîte ». Mais j’ai été tellement prise par la question de savoir comment l’embryon s’auto-organise que je n’ai pas baissé les bras et, petit à petit, nous avons progressé.
Lorsque j’ai lancé mon groupe de recherche à Cambridge, j’ai mis en place des moyens d’étudier la «boîte noire du développement» – le développement de l’embryon au moment de l’implantation. Mes mentors m’avaient découragé de le poursuivre pendant mon doctorat parce qu’ils craignaient qu’il soit difficile de faire la lumière à l’intérieur de cette « boîte ». Mais j’ai été tellement prise par la question de savoir comment l’embryon s’auto-organise que je n’ai pas baissé les bras et, petit à petit, nous avons progressé. Mon conseil à tous les jeunes scientifiques est de suivre votre cœur. Étudiez un sujet qui vous inspire et choisissez un conseiller qui peut vous soutenir dans votre style de travail. À mon avis, il est important de guider les jeunes scientifiques dans le laboratoire, mais aussi de leur donner un espace pour explorer leur individualité. Mon expérience est que les défis pour les femmes scientifiques augmentent à mesure qu’elles progressent dans leur carrière. Aux stades ultérieurs, il est essentiel d’avoir des mentors qui comprennent non seulement la science, mais aussi comment l’équilibrer avec la vie quotidienne, y compris fonder une famille.
Mon conseil à tous les jeunes scientifiques est de suivre votre cœur. Étudiez un sujet qui vous inspire et choisissez un conseiller qui peut vous soutenir dans votre style de travail. À mon avis, il est important de guider les jeunes scientifiques dans le laboratoire, mais aussi de leur donner un espace pour explorer leur individualité. Mon expérience est que les défis pour les femmes scientifiques augmentent à mesure qu’elles progressent dans leur carrière. Aux stades ultérieurs, il est essentiel d’avoir des mentors qui comprennent non seulement la science, mais aussi comment l’équilibrer avec la vie quotidienne, y compris fonder une famille. Au cours de ma propre grossesse, j’ai été choquée lorsqu’un dépistage précoce a révélé des anomalies. Le prélèvement concernait des cellules extra-embryonnaires, j’ai donc attendu l’amniocentèse, qui prélève des cellules fœtales tombées dans le liquide amniotique. C’était normal, ce qui me rassure. L’expérience m’a amené à étudier l’aneuploïdie en mosaïque – une condition dans laquelle l’embryon a des cellules avec le mauvais nombre de chromosomes aux côtés de cellules chromosomiquement normales. Incroyablement, nous avons découvert que ces cellules anormales peuvent être éliminées et que les cellules normales et saines compensent leur absence. Pour une raison quelconque, ce mécanisme ne fonctionne pas dans les tissus qui construisent le placenta, et nous essayons toujours de comprendre pourquoi et comment.
Au cours de ma propre grossesse, j’ai été choquée lorsqu’un dépistage précoce a révélé des anomalies. Le prélèvement concernait des cellules extra-embryonnaires, j’ai donc attendu l’amniocentèse, qui prélève des cellules fœtales tombées dans le liquide amniotique. C’était normal, ce qui me rassure. L’expérience m’a amené à étudier l’aneuploïdie en mosaïque – une condition dans laquelle l’embryon a des cellules avec le mauvais nombre de chromosomes aux côtés de cellules chromosomiquement normales. Incroyablement, nous avons découvert que ces cellules anormales peuvent être éliminées et que les cellules normales et saines compensent leur absence. Pour une raison quelconque, ce mécanisme ne fonctionne pas dans les tissus qui construisent le placenta, et nous essayons toujours de comprendre pourquoi et comment.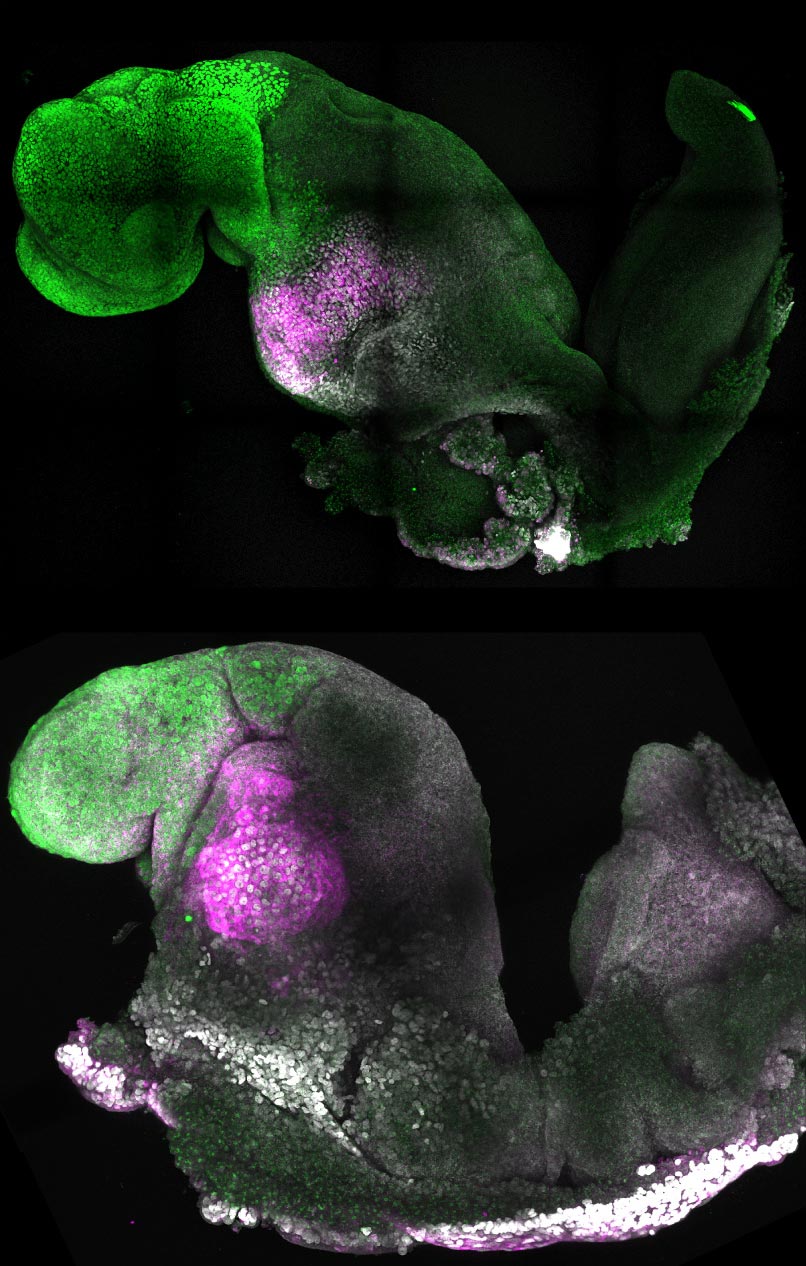 La science est exigeante, c’est un travail acharné et cela prend la plupart de vos heures d’éveil. Je déconnecte en regardant des films — je regarde beaucoup de films étrangers en polonais, français et danois, ainsi que des documentaires et des films d’art. Mais quand je veux me perdre dans un autre récit, je regarde des drames. Je suis également récemment converti au jardinage, où je peux encourager le développement réussi d’autres formes de vie !
La science est exigeante, c’est un travail acharné et cela prend la plupart de vos heures d’éveil. Je déconnecte en regardant des films — je regarde beaucoup de films étrangers en polonais, français et danois, ainsi que des documentaires et des films d’art. Mais quand je veux me perdre dans un autre récit, je regarde des drames. Je suis également récemment converti au jardinage, où je peux encourager le développement réussi d’autres formes de vie !
C’est un sentiment incroyable et un privilège d’avoir cet aperçu direct des origines d’une nouvelle vie. C’est comme découvrir une nouvelle planète dont on ignorait l’existence.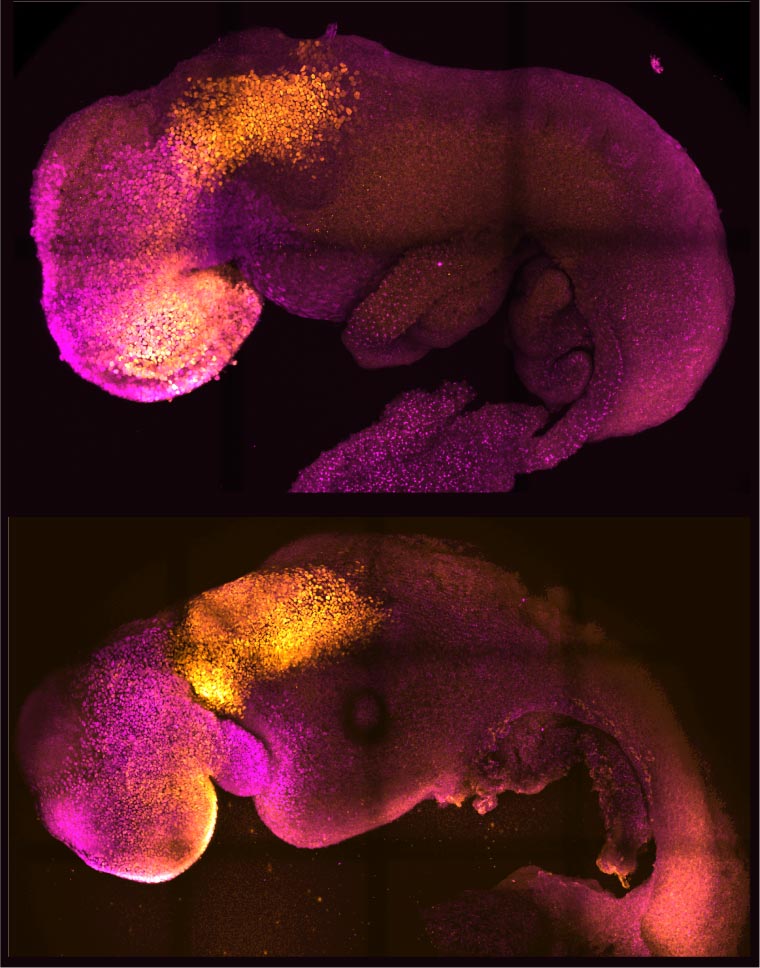
Scientists Grow “Synthetic” Embryo With Brain and Beating Heart – Without Eggs or Sperm
https://www.genome.gov/about-genomics/educational-resources/fact-sheets/human-genome-project