 Une étude démontre une méthode de réparation des gènes dans les embryons humains qui prévient les maladies héréditaires
Une étude démontre une méthode de réparation des gènes dans les embryons humains qui prévient les maladies héréditaires Première édition réussie de gènes dans des embryons humains pour réparer une mutation pathogène rapportée par des scientifiques dans «Nature»
Première édition réussie de gènes dans des embryons humains pour réparer une mutation pathogène rapportée par des scientifiques dans «Nature» CRISPR fixe le gène de la maladie dans des embryons humains viables
CRISPR fixe le gène de la maladie dans des embryons humains viables L’expérience d’édition de gènes repousse les limites scientifiques et éthiques.
L’expérience d’édition de gènes repousse les limites scientifiques et éthiques.
Aujourd’hui, une équipe internationale de scientifiques rapporte qu’elle a, pour la première fois, trouvé un moyen de modifier avec succès l’ADN d’embryons humains – sans introduire les mutations nocives qui posaient problème lors de précédentes tentatives ailleurs. 
La recherche vise ultimement à aider les familles aux prises avec des maladies génétiques. La nouvelle expérience a utilisé une nouvelle technique puissante d’édition de gènes pour corriger un défaut génétique à l’origine d’un trouble cardiaque qui peut provoquer la mort soudaine d’une insuffisance cardiaque chez des jeunes apparemment en bonne santé.
Scientific & ethical boundaries pushed as CRISPR used to fix disease gene in viable human embryos: https://t.co/DXF9YTyyIm pic.twitter.com/BUNZnqVH3L
— nature (@Nature) August 3, 2017
L’expérience a corrigé le défaut dans près des deux tiers de plusieurs dizaines d’embryons, sans provoquer de mutations potentiellement dangereuses ailleurs dans l’ADN.
Aucun des embryons n’a été utilisé pour essayer de créer un bébé. Mais si de futures expériences confirment que les techniques sont sûres et efficaces, les scientifiques disent que la même approche pourrait être utilisée pour prévenir une longue liste de maladies héréditaires.
« Potentiellement, nous parlons de milliers de gènes et de milliers de patients », déclare Paula Amato, professeure agrégée d’obstétrique et de gynécologie à l’Oregon Health & Science University de Portland. Elle était membre de l’équipe scientifique des États-Unis, de la Chine et de la Corée du Sud. D’autres maladies qui pourraient finalement bénéficier d’une telle approche comprennent la maladie de Huntington, la fibrose kystique, peut-être une forme héréditaire de la maladie d’Alzheimer et des cas de cancer du sein et de l’ovaire causés par des mutations dans les gènes BRCA. Néanmoins, le travail déclenche des sonnettes d’alarme parmi les critiques du monde entier.
Néanmoins, le travail déclenche des sonnettes d’alarme parmi les critiques du monde entier.
« Je pense que c’est extrêmement dérangeant », déclare Marcy Darnovsky, qui dirige le Center for Genetics and Society, un groupe de surveillance de la génétique à Berkeley, en Californie. « C’est un mépris flagrant des appels à un large consensus sociétal dans les décisions concernant une technologie vraiment capitale qui pourrait être bien utilisé, mais dans ce cas, il est utilisé en préparation d’une application extrêmement risquée. »
« Si les scientifiques irresponsables ne sont pas arrêtés, le monde pourrait bientôt se retrouver devant le fait accompli du premier bébé [génétiquement modifié] », déclare David King, qui dirige le groupe Human Genetics Alert basé au Royaume-Uni. « Nous appelons les gouvernements et les organisations internationales à se réveiller et à adopter une interdiction mondiale immédiate de créer des bébés clonés ou GM, avant qu’il ne soit trop tard. » Amato et d’autres soulignent que leur travail vise à prévenir de terribles maladies, et non à créer des personnes génétiquement améliorées. Et ils notent que beaucoup plus de recherches sont nécessaires pour confirmer que la technique est sûre et efficace avant que quiconque essaie de faire un bébé de cette façon.
Amato et d’autres soulignent que leur travail vise à prévenir de terribles maladies, et non à créer des personnes génétiquement améliorées. Et ils notent que beaucoup plus de recherches sont nécessaires pour confirmer que la technique est sûre et efficace avant que quiconque essaie de faire un bébé de cette façon.
Mais les scientifiques qui espèrent poursuivre les travaux aux États-Unis se heurtent à de nombreux obstacles réglementaires. Les National Institutes of Health ne financeront aucune recherche impliquant des embryons humains (le nouveau travail a été financé par l’Oregon Health & Science University). Et le Congrès interdit à la Food and Drug Administration d’envisager toute expérience impliquant des embryons humains génétiquement modifiés .Néanmoins, les chercheurs disent qu’ils espèrent poursuivre les travaux, peut-être en Grande-Bretagne. Le Royaume-Uni a autorisé les expériences génétiques impliquant des embryons humains interdites aux États-Unis.
.Néanmoins, les chercheurs disent qu’ils espèrent poursuivre les travaux, peut-être en Grande-Bretagne. Le Royaume-Uni a autorisé les expériences génétiques impliquant des embryons humains interdites aux États-Unis.
« Si d’autres pays seraient intéressés, nous serions heureux de travailler avec leurs organismes de réglementation », a déclaré Shoukhrat Mitalipov, directeur du Centre de thérapie cellulaire et génique embryonnaire de l’Oregon Health & Science University.
Une préoccupation majeure est la sécurité d’un embryon en développement – si des embryons humains génétiquement modifiés produiraient effectivement des bébés en bonne santé. Mais à un niveau plus large, toute modification apportée à l’ADN d’un embryon serait transmise de génération en génération. Cela fait craindre que toute erreur dans l’édition qui a causé par inadvertance de nouvelles maladies ne devienne une partie permanente du plan génétique de cette famille.
Darnovsky et d’autres craignent également que la modification de l’ADN humain dans un embryon ne donne naissance à des « bébés sur mesure ». C’est alors que les parents sélectionnent et choisissent les traits de leurs enfants pour essayer de les rendre plus intelligents, plus grands, plus forts ou avoir d’autres traits qui les font paraître supérieurs. Ce n’est pas encore techniquement possible. Mais les critiques craignent que les scientifiques ne se dirigent déjà dans cette direction.
« Le scénario est que vous auriez des cliniques de fertilité faisant de la publicité auprès des personnes qui souhaitent concevoir leurs futurs enfants afin qu’ils puissent être présentés comme » améliorés « – comme biologiquement meilleurs que tout le monde », explique Darnovsky. « Ce n’est pas un monde que nous voulons construire. Ce n’est pas un monde dans lequel nous voulons vivre. »
Des chercheurs peu scrupuleux pourraient également précipiter la technologie dans les cliniques de fertilité pour essayer de commencer à créer des bébés qu’ils peuvent facturer comme génétiquement améliorés avant même que la technologie n’ait été prouvée sûre et avant qu’un consensus sociétal n’ait été atteint sur les applications qui devraient être autorisées.
« C’est une déclaration forte que nous pouvons faire de l’édition du génome », déclare Daley de Harvard. « La question qui reste est: » Devrions-nous? Nous avons besoin d’un débat public plus approfondi sur les implications éthiques de cette technologie. »
Darnovsky et certains scientifiques affirment que de nombreux couples porteurs de maladies génétiques disposent déjà d’alternatives plus sûres à ce type d’édition génétique. Les couples porteurs de maladies génétiques peuvent passer par la fécondation in vitro (FIV) et faire tester leurs embryons avant d’être implantés dans l’utérus.
« J’admettrai éprouver un sentiment de perplexité », déclare Fyodor Urnov, directeur associé à l’Institut Altius pour les sciences biomédicales, un institut de recherche à but non lucratif à Seattle.
« La question que je me pose est la suivante : ‘Pourquoi vous êtes-vous donné la peine, étant donné qu’il existe un moyen sûr, efficace, approuvé et éthique d’atteindre exactement l’objectif que vous vous êtes fixé sans aucun des obstacles logiques et éthiques importants liés au fait d’avoir à modifier un embryon humain? » Urnov dit.
Amato et les autres scientifiques de l’équipe internationale affirment que leur approche pourrait offrir une alternative aux couples pour qui ces options standard ne fonctionneront pas ou sont moins souhaitables. Mais ils conviennent que le travail ne devrait avancer qu’avec une surveillance réglementaire attentive pour prévenir les abus.
« Chaque fois qu’il y a une nouvelle technologie, il y a un potentiel d’utilisation abusive. Nous devons le reconnaître », déclare Amato. « Personnellement, je ne pense pas que ce soit une raison de ne pas poursuivre la recherche si vous pensez qu’il existe un avantage potentiel qui l’emporte sur ce risque. Et je pense que si vous pouvez prévenir une maladie grave chez les générations futures, cela vaut la peine de poursuivre cela. »
L’avancée a été signalée pour la première fois la semaine dernière dans Technology Review, un magazine publié par le Massachusetts Institute of Technology. Mais les détails ont été retenus et les chercheurs n’ont pas donné de détails avant que l’article scientifique n’ait fini d’être examiné par d’autres scientifiques pour publication dans Nature.
Pour leurs expériences, les scientifiques ont obtenu du sperme d’un donneur porteur d’une mutation pour la cardiomyopathie, un trouble cardiaque. Ils ont ensuite utilisé ce sperme pour féconder des dizaines d’ovules obtenus de femmes en bonne santé.
Parallèlement à la fécondation, les chercheurs ont injecté un puissant outil microscopique d’édition de gènes connu sous le nom de CRISPR-Cas9. La nouvelle technique permet beaucoup plus facilement que les approches précédentes d’apporter des modifications très précises à l’ADN
Plusieurs scientifiques ont comparé l’approche à la chirurgie des fœtus lorsqu’ils sont dans l’utérus. Mais cela pousse cette idée beaucoup plus loin et implique de réparer l’ADN endommagé au niveau moléculaire dans l’utérus.
« C’est de la nano-chirurgie », déclare George Church, un éminent généticien de Harvard qui n’a pas non plus participé à la recherche. « Vous le faites avec le meilleur scalpel possible. »
L’outil d’édition a coupé très précisément un gène muté connu sous le nom de MYBPC3, qui provoque une cardiomyopathie. À la surprise des chercheurs, la coupure a incité les embryons à réparer eux-mêmes le gène défectueux. Il s’agit d’un processus qui était auparavant inconnu, disent les scientifiques.
« Le moment le plus excitant a été lorsque nous avons réalisé le mécanisme de réparation », explique Amato. « Ça se réparait tout seul. ». Les chercheurs ont ensuite laissé les embryons se développer pendant plusieurs jours afin de pouvoir les analyser pour voir si les expériences fonctionnaient bien. Dans une partie des expériences impliquant 58 embryons, l’approche a corrigé la mutation dans plus de 70% des embryons, ont rapporté les chercheurs.
Les chercheurs ont ensuite laissé les embryons se développer pendant plusieurs jours afin de pouvoir les analyser pour voir si les expériences fonctionnaient bien. Dans une partie des expériences impliquant 58 embryons, l’approche a corrigé la mutation dans plus de 70% des embryons, ont rapporté les chercheurs.
« Le défaut génétique a été corrigé avec une grande efficacité », explique Amato.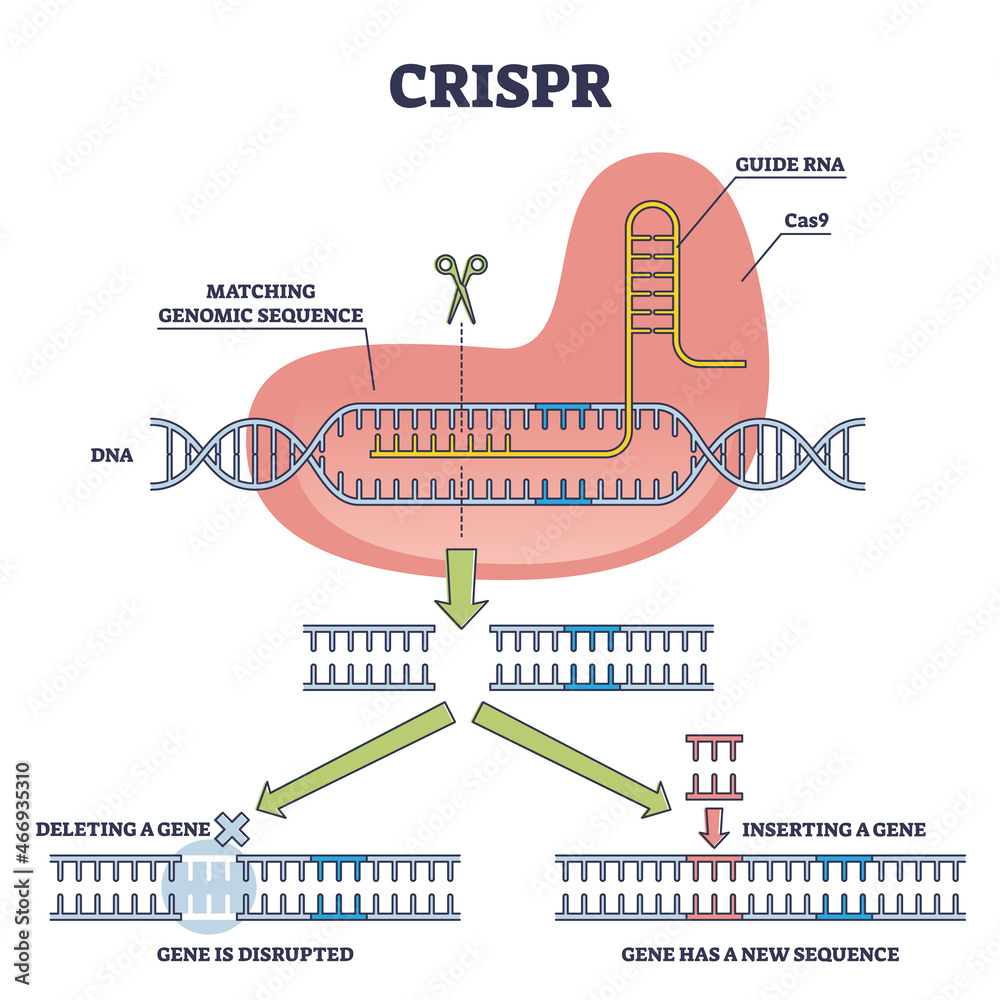 De plus, une analyse génétique détaillée des embryons a conclu que l’édition génétique n’avait pas causé de problèmes de sécurité.
De plus, une analyse génétique détaillée des embryons a conclu que l’édition génétique n’avait pas causé de problèmes de sécurité.
« Je pense que c’est une avancée significative », déclare Church. « C’est important. »
En 2015, des scientifiques chinois ont déclaré avoir tenté de modifier l’ADN d’embryons pour la première fois, en utilisant également CRISPR-Cas9. Mais cette expérience impliquait des embryons qui ne pourraient jamais se développer normalement. Et bien que ces chercheurs aient réussi à éditer le défaut ciblé, cela a également produit des défauts involontaires ailleurs dans l’ADN des embryons.
« C’était la clé », dit Mitalipov.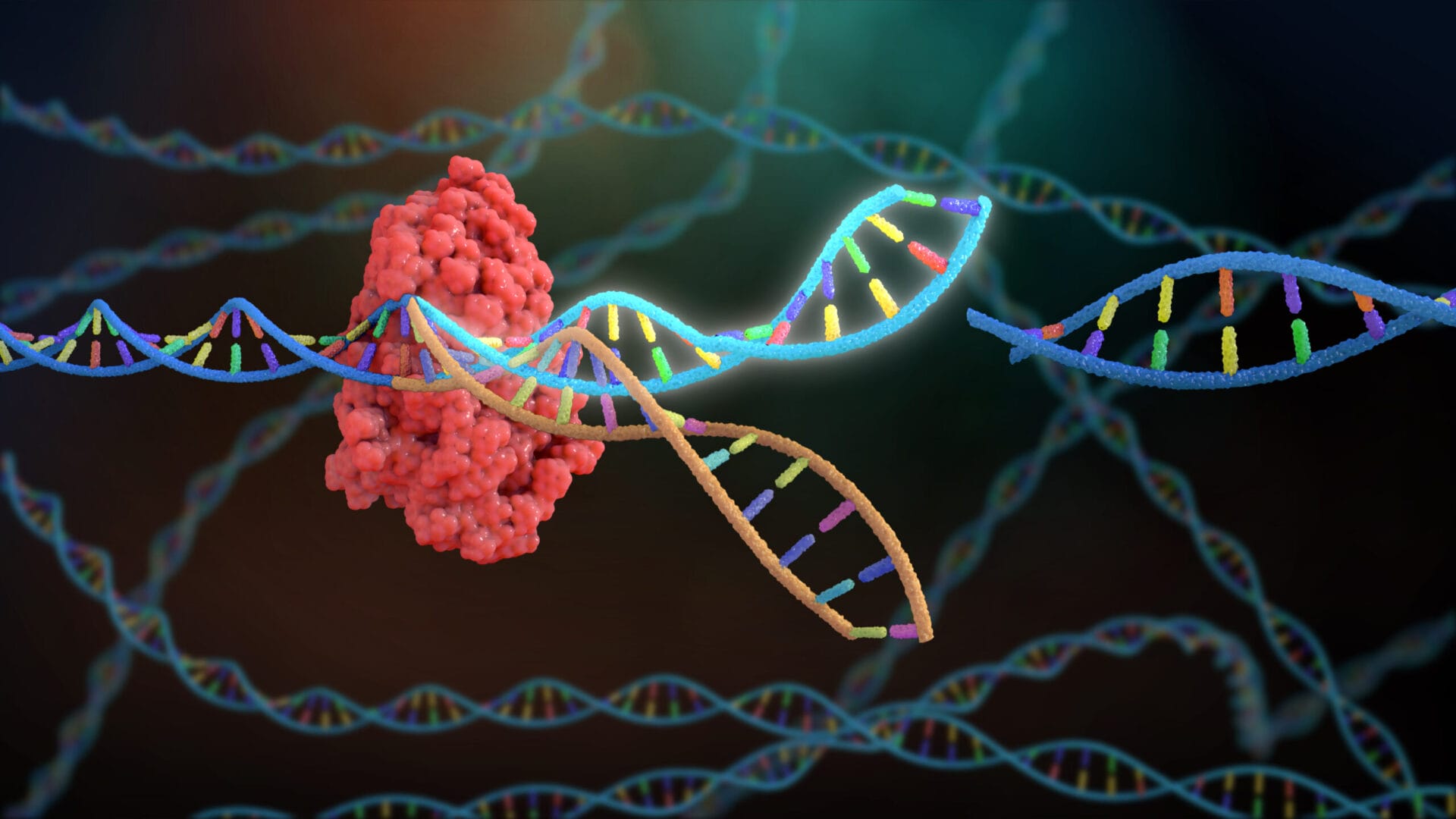
Alta Charo, bioéthicienne à l’Université du Wisconsin, a rejeté les inquiétudes concernant le travail menant aux bébés sur mesure.
« Ce n’est pas l’aube de l’ère du bébé sur mesure », déclare Charo, qui a coprésidé un comité formé par les Académies nationales des sciences et l’Académie nationale de médecine pour déterminer si de telles expériences devraient être autorisées. Le comité a conclu plus tôt cette année que l’édition génétique d’embryons humains pourrait être autorisée dans de rares cas lorsqu’aucune autre option n’est disponible, mais uniquement pour traiter des maladies.
Entre-temps, des scientifiques britanniques ont obtenu l’autorisation d’utiliser CRISPR pour modifier l’ADN d’embryons humains sains afin d’en savoir plus sur le développement humain normal. Une équipe en Suède a commencé des expériences similaires.
« Je pense que cela doit être strictement réglementé », déclare Fredrik Lanner, généticien à l’Institut Karolinska de Stockholm qui mène ces expériences. « C’est très excitant. Mais cela pourrait aussi être une arme à double tranchant. Je pense donc que nous devons vraiment être très prudents avec cette technologie. »
Les débats sur le moment et la manière d’utiliser l’outil chez l’homme revêtent une nouvelle urgence
Les scientifiques ont rapporté pour la première fois cette année avoir modifié sélectivement des gènes dans des embryons humains viables. Depuis près de cinq ans, les chercheurs utilisent les ciseaux moléculaires connus sous le nom de CRISPR/Cas9 pour apporter des modifications précises à l’ADN des animaux. Mais son utilisation dans les embryons humains a des implications plus profondes, disent les chercheurs et les éthiciens. « Nous pouvons désormais littéralement changer notre propre espèce », déclare Mildred Solomon, bioéthicienne et présidente du Hastings Center, un institut de recherche en bioéthique à Garrison, NY.
« Nous pouvons désormais littéralement changer notre propre espèce », déclare Mildred Solomon, bioéthicienne et présidente du Hastings Center, un institut de recherche en bioéthique à Garrison, NY.
CRISPR/Cas9 est un système immunitaire bactérien ( SN : 15/04/17, p. 22 ) transformé en un puissant outil d’édition de gènes. Décrit pour la première fois en 2012, l’éditeur se compose d’une enzyme coupant l’ADN appelée Cas9 et d’un court morceau d’ARN qui guide l’enzyme vers un endroit spécifique que les scientifiques souhaitent modifier. Une fois que la machinerie d’édition atteint sa destination, Cas9 clive l’ADN. Les cellules peuvent réparer la rupture en recollant les extrémités coupées ensemble ou en collant un autre morceau d’ADN. Les scientifiques ont développé des variantes de l’éditeur qui apportent d’autres modifications à l’ADN sans couper, y compris une version décrite en octobre qui effectue une conversion auparavant impossible d’une base d’ADN en une autre .
La question de savoir si les scientifiques devraient utiliser le pouvoir de CRISPR/Cas9 pour créer des bébés génétiquement modifiés fait l’objet d’un débat houleux. Jusqu’en mars, les batailles étaient principalement académiques car les tentatives précédentes de modification d’embryons humains avaient été menées sur des embryons qui ne se développeraient jamais en bébé. Mais en mars, Lichun Tang du Centre de recherche sur les protéomes de Pékin en Chine et ses collègues ont déclaré avoir utilisé CRISPR/Cas9 pour corriger les mutations pathogènes dans un petit nombre d’embryons humains viables. D’autres groupes ont publié des rapports séparés sur la réparation CRISPR/Cas9 dans des embryons humains viables en août et octobre. Plutôt que de supprimer les problèmes, un autre groupe dirigé par la biologiste du développement Kathy Niakan du Francis Crick Institute de Londres a coupé l’ADN avec CRISPR/Cas9 pour créer intentionnellement des mutations dans des embryons humains pour la première fois. Ces embryons ont été utilisés pour étudier le rôle d’un gène important dans le développement .
Plutôt que de supprimer les problèmes, un autre groupe dirigé par la biologiste du développement Kathy Niakan du Francis Crick Institute de Londres a coupé l’ADN avec CRISPR/Cas9 pour créer intentionnellement des mutations dans des embryons humains pour la première fois. Ces embryons ont été utilisés pour étudier le rôle d’un gène important dans le développement .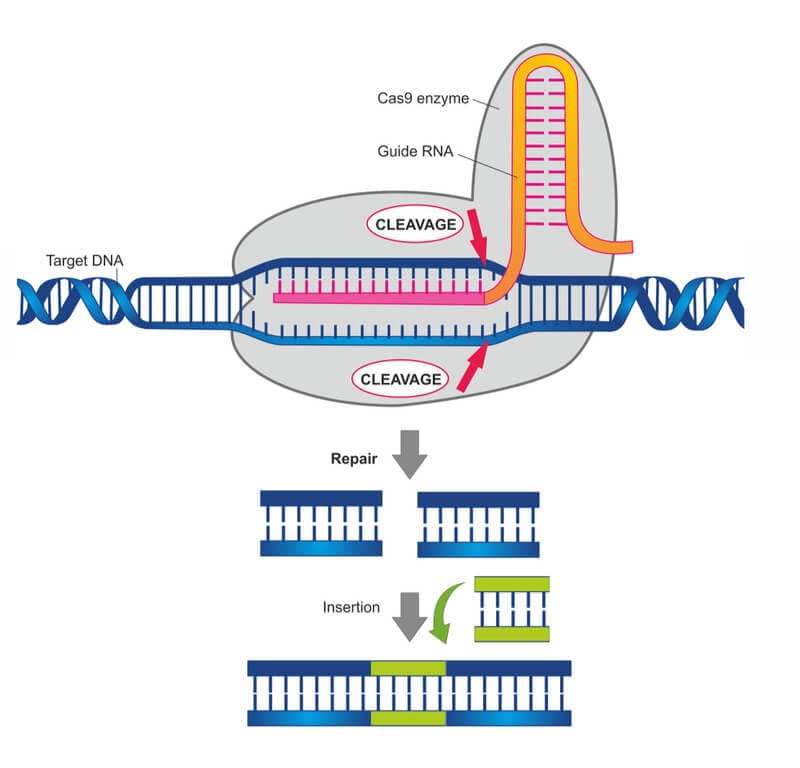 Ensemble, les études illustrent que la technologie d’édition de gènes peut apporter une variété de changements dans l’ADN humain qui dureraient toute une vie et s’étendraient sur plusieurs générations. C’est la relative facilité et la permanence qui inquiètent de nombreuses personnes que CRISPR/Cas9 puisse conduire à de nouvelles classes de personnes génétiquement améliorées et à la discrimination contre d’autres personnes nées avec des maladies génétiques non corrigées. Poussée à l’extrême, cette discrimination pourrait s’étendre aux personnes dont les parents ont choisi de ne pas (ou n’ont pas eu les moyens de) modifier génétiquement la puissance athlétique, les capacités intellectuelles ou d’autres caractéristiques de leurs enfants.
Ensemble, les études illustrent que la technologie d’édition de gènes peut apporter une variété de changements dans l’ADN humain qui dureraient toute une vie et s’étendraient sur plusieurs générations. C’est la relative facilité et la permanence qui inquiètent de nombreuses personnes que CRISPR/Cas9 puisse conduire à de nouvelles classes de personnes génétiquement améliorées et à la discrimination contre d’autres personnes nées avec des maladies génétiques non corrigées. Poussée à l’extrême, cette discrimination pourrait s’étendre aux personnes dont les parents ont choisi de ne pas (ou n’ont pas eu les moyens de) modifier génétiquement la puissance athlétique, les capacités intellectuelles ou d’autres caractéristiques de leurs enfants.
En février, un panel d’éthiciens et d’autres experts réunis par les Académies nationales des sciences, de l’ingénierie et de la médecine des États-Unis a mis en garde contre l’utilisation de CRISPR pour améliorer la santé ou d’autres traits . Mais le panel a déclaré que l’utilisation de l’édition de gènes humains pour corriger des maladies, dans certaines circonstances, pourrait être autorisée. Aucun bébé n’est né avec des modifications apportées par CRISPR/Cas9 ou toute autre technologie d’édition de gènes. Mais ce ne pouvait être qu’une question de temps. « Je ne serais pas surpris s’il y avait un bébé modifié par CRISPR quelque part dans le monde au cours des deux prochaines années », a déclaré Jennifer Doudna, pionnière de CRISPR de l’Université de Californie à Berkeley, le 26 octobre à San Francisco lors de la Conférence mondiale des sciences. Journalistes. Doudna a déclaré qu’elle ne soutenait pas l’utilisation de CRISPR/Cas9 pour créer des bébés génétiquement modifiés.
Aucun bébé n’est né avec des modifications apportées par CRISPR/Cas9 ou toute autre technologie d’édition de gènes. Mais ce ne pouvait être qu’une question de temps. « Je ne serais pas surpris s’il y avait un bébé modifié par CRISPR quelque part dans le monde au cours des deux prochaines années », a déclaré Jennifer Doudna, pionnière de CRISPR de l’Université de Californie à Berkeley, le 26 octobre à San Francisco lors de la Conférence mondiale des sciences. Journalistes. Doudna a déclaré qu’elle ne soutenait pas l’utilisation de CRISPR/Cas9 pour créer des bébés génétiquement modifiés.
Des chercheurs, dont Shoukhrat Mitalipov de l’Oregon Health & Science University à Portland, affirment qu’il est important d’améliorer la technologie pour la rendre plus sûre et plus efficace pour lutter contre les maladies génétiques à leur source – les gènes défectueux. Une étude de Mitalipov et ses collègues, publiée dans Nature en août, suggère que la fabrication de soi-disant «bébés sur mesure» pourrait être plus difficile que prévu. Au lieu d’utiliser un morceau d’ADN que les chercheurs ont injecté pour réparer les coupures faites par CRISPR/Cas9, les embryons humains ont utilisé leur propre ADN d’un autre chromosome comme modèle de réparation. Cela pourrait rendre plus difficile l’ajout de gènes extérieurs pour améliorer les traits, mais la fixation de certaines mutations pathogènes serait potentiellement plus facile, dit Mitalipov. S’il existe une copie saine du gène, la cellule l’utiliserait théoriquement comme modèle de réparation.
Mitalipov et sa collègue de l’Oregon, Paula Amato, disent avoir soumis plus de preuves pour étayer leur affirmation à Nature et espèrent publier les données bientôt. La découverte doit être reproduite par d’autres groupes, dit Amato, mais « pour le moment, nous maintenons nos conclusions ».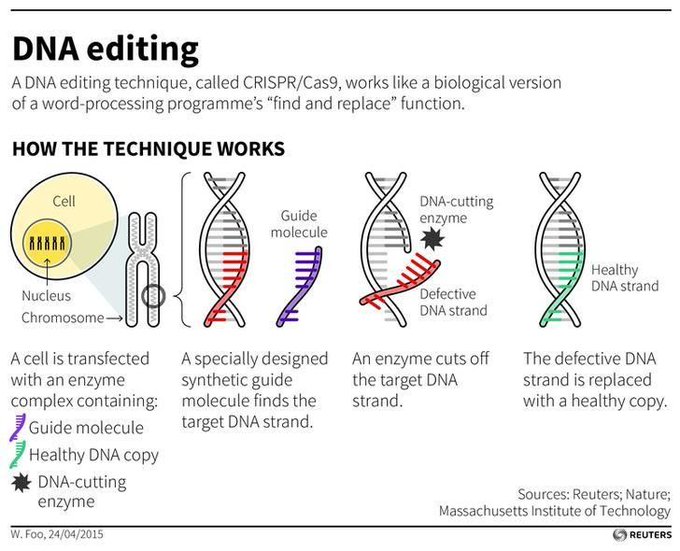
Ensuite, une équipe de chercheurs chinois a utilisé cet éditeur de base pour corriger une mutation dans les embryons humains qui cause le trouble sanguin bêta-thalassémie , rapporté le 23 septembre dans Protein & Cell . En octobre, Liu et ses collègues ont rapporté qu’ils avaient créé un autre éditeur de base capable de réaliser une astuce auparavant impossible : convertir un A en G. Les deux éditeurs de base peuvent permettre aux chercheurs de réparer la plupart des mutations de base uniques responsables de l’origine humaine. maladies telles que la drépanocytose, la dystrophie musculaire et la fibrose kystique.

Dans un article publié dans Nature aujourd’hui, le 2 août 2017, Shoukhrat Mitalipov, Ph.D., a rapporté l’élimination réussie d’un défaut génétique mortel chez les embryons humains. La technique d’édition de gènes décrite dans cette étude pourrait un jour offrir aux personnes atteintes de mutations génétiques héréditaires connues à l’origine de maladies la possibilité d’éliminer le risque de transmettre la maladie à leurs enfants. L’étude a également démontré un moyen de surmonter un problème crucial dans l’édition du génome. Connu sous le nom de mosaïcisme, le problème survient lorsque toutes les cellules d’un embryon multicellulaire ne sont pas réparées et que certaines cellules portent encore une mutation. Ceux-ci pourraient finalement se retrouver dans l’ADN d’une progéniture, rendant la réparation sans objet.
La technique d’édition de gènes décrite dans cette étude pourrait un jour offrir aux personnes atteintes de mutations génétiques héréditaires connues à l’origine de maladies la possibilité d’éliminer le risque de transmettre la maladie à leurs enfants. L’étude a également démontré un moyen de surmonter un problème crucial dans l’édition du génome. Connu sous le nom de mosaïcisme, le problème survient lorsque toutes les cellules d’un embryon multicellulaire ne sont pas réparées et que certaines cellules portent encore une mutation. Ceux-ci pourraient finalement se retrouver dans l’ADN d’une progéniture, rendant la réparation sans objet.
La nouvelle étude est la première à démontrer que la technique peut être utilisée dans des embryons humains pour reconvertir des gènes mutants à la normale.
L’histoire derrière l’histoire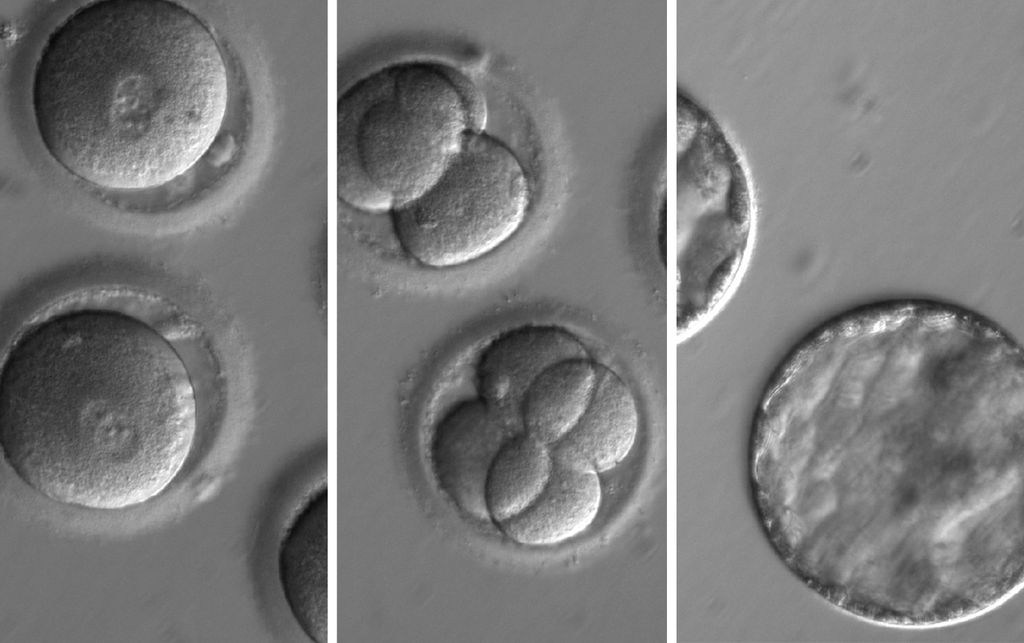
https://blogs.ohsu.edu/researchnews/2017/08/02/preventing-cardiomyopathy-through-gene-correction/
.png) Les scientifiques bricolent l’ADN des humains et d’autres êtres vivants depuis des décennies. Mais une chose a longtemps été considérée comme interdite : modifier l’ADN humain d’une manière qui pourrait être transmise de génération en génération.
Les scientifiques bricolent l’ADN des humains et d’autres êtres vivants depuis des décennies. Mais une chose a longtemps été considérée comme interdite : modifier l’ADN humain d’une manière qui pourrait être transmise de génération en génération.