

 Johann Kjeldahl, chimiste danois qui a développé une méthode pour mesurer le taux d’azote dans la matière organique
Johann Kjeldahl, chimiste danois qui a développé une méthode pour mesurer le taux d’azote dans la matière organique Johann Kjeldahl (1849-1900)
Johann Kjeldahl (1849-1900) C’était un chimiste danois qui a développé une méthode de renommée mondiale pour la détermination de la quantité d’azote de certains composés chimiques en utilisant une technique de laboratoire appelée méthode Kjeldahl.
C’était un chimiste danois qui a développé une méthode de renommée mondiale pour la détermination de la quantité d’azote de certains composés chimiques en utilisant une technique de laboratoire appelée méthode Kjeldahl.
Kjeldahl, Johann Gustav Christoffer ( né le 16 août 1849 à Jagerpris, Danemark ; décédé le 18 juillet 1900 à Tisvildeleje, Danemark)
Chimie analytique
Le père de Kjeldahl était médecin de district dans son village natal sur l’île de Sjaelland ; sa mère était Johanne Lohmann. Il a fait ses études au Gymnasium de Roskilde puis a étudié la chimie à l’Institut technologique de Copenhague. Il réussit son examen d’État « en sciences appliquées » avec mention en 1873 et devint instructeur au Collège d’agriculture. Il y fait la connaissance de JC Jacobsen, propriétaire de la brasserie Carlsberg, qui l’engage en 1875 pour créer un laboratoire d’analyses techniques diverses. Jacobsen a rapidement créé la Fondation Carlsberg qui a aidé à fonder le Laboratoire Carlsberg, une institution de recherche scientifique. En 1876, Kjeldahl fut nommé directeur du laboratoire, poste qu’il occupa jusqu’à sa mort. Le nom de Kjeldahl est surtout connu pour la « méthode Kjeldahl » pour l’estimation de l’azote dans les substances organiques. Cette découverte, d’une si grande valeur en chimie analytique, a d’abord été faite comme une étape auxiliaire dans ses efforts pour développer une méthode à utiliser dans des expériences en chimie agricole. Pourtant, sa méthode de détermination de l’azote est bien plus importante que tous ses résultats en chimie agricole. Kjeldahl s’est rendu compte du problème lié à la détermination de l’azote en étudiant la transformation des protéines dans la fermentation de la bière.
Le nom de Kjeldahl est surtout connu pour la « méthode Kjeldahl » pour l’estimation de l’azote dans les substances organiques. Cette découverte, d’une si grande valeur en chimie analytique, a d’abord été faite comme une étape auxiliaire dans ses efforts pour développer une méthode à utiliser dans des expériences en chimie agricole. Pourtant, sa méthode de détermination de l’azote est bien plus importante que tous ses résultats en chimie agricole. Kjeldahl s’est rendu compte du problème lié à la détermination de l’azote en étudiant la transformation des protéines dans la fermentation de la bière.
Lavoisier pensait que les substances organiques étaient constituées uniquement de carbone, d’hydrogène et d’oxygène, tandis que Berthollet découvrit en 1786 que certaines substances d’origine animale contenaient de l’azote. Après les expériences de Gay-Lussac et de Thénard, Dumas réussit enfin en 1831 à créer une méthode pratique de dosage de l’azote, qui nécessitait combustion et mesure gazométrique. Comme il ressort de la littérature contemporaine, la méthode de Dumas était « un tourment pour tout le monde » parce qu’elle était si compliquée. Une méthode humide appropriée avait longtemps été recherchée pour remplacer la méthode de combustion de Dumas. En 1841, Franz Varrentrapp et Heinrich Will ont créé une méthode dans laquelle la substance était chauffée avec de l’hydroxyde de baryum, l’azote était converti en ammoniac, et ce dernier était conduit dans de l’acide chlorhydrique et précipité avec du chlorure platinique. Kjeldahl s’est attaqué systématiquement au problème en partant de l’observation de James Wanklyn selon laquelle, dans certaines conditions, le permanganate de potassium transforme l’azote des corps organiques en ammoniac. Ce phénomène ne se produit cependant que très irrégulièrement. Kjeldahl a découvert que dans l’acide sulfurique concentré , l’oxydation et la conversion par le permanganate ont lieu régulièrement et quantitativement, et il a déterminé la quantité d’ammoniac par titrage. Il rapporta sa méthode à la Chemical Society of Copenhagen le 7 mars 1883 ( Zeitschrift für analytische Chemie , 22 [1883], 366).
Kjeldahl s’est attaqué systématiquement au problème en partant de l’observation de James Wanklyn selon laquelle, dans certaines conditions, le permanganate de potassium transforme l’azote des corps organiques en ammoniac. Ce phénomène ne se produit cependant que très irrégulièrement. Kjeldahl a découvert que dans l’acide sulfurique concentré , l’oxydation et la conversion par le permanganate ont lieu régulièrement et quantitativement, et il a déterminé la quantité d’ammoniac par titrage. Il rapporta sa méthode à la Chemical Society of Copenhagen le 7 mars 1883 ( Zeitschrift für analytische Chemie , 22 [1883], 366).
En 1890, Kjeldahl a été élu à la Société danoise des sciences. Bien que sujet à une dépression morbide, il était néanmoins capable d’entreprendre des recherches régulières quoique de moins en moins étendues et, dans ses dernières années, il dut parfois s’arrêter complètement de travailler. Il voyagea beaucoup pour des raisons de santé et mourut d’une crise cardiaque en se baignant dans la mer.
La méthode Kjeldahl
La détermination de l’azote a une longue histoire dans le domaine de la chimie analytique. Johan Kjeldahl a introduit la méthode Kjeldahl pour la première fois en 1883 lors d’une réunion de la Société danoise de chimie.
Johan Kjeldahl, alors directeur du laboratoire Carlsberg, a été chargé d’observer scientifiquement les processus impliqués dans la production de bière.
Tout en étudiant les protéines pendant la production de malt, il a développé une méthode de détermination de la teneur en azote qui était plus rapide et plus précise que n’importe quelle méthode disponible à l’époque.
L’azote total Kjeldahl est polyvalent et efficace
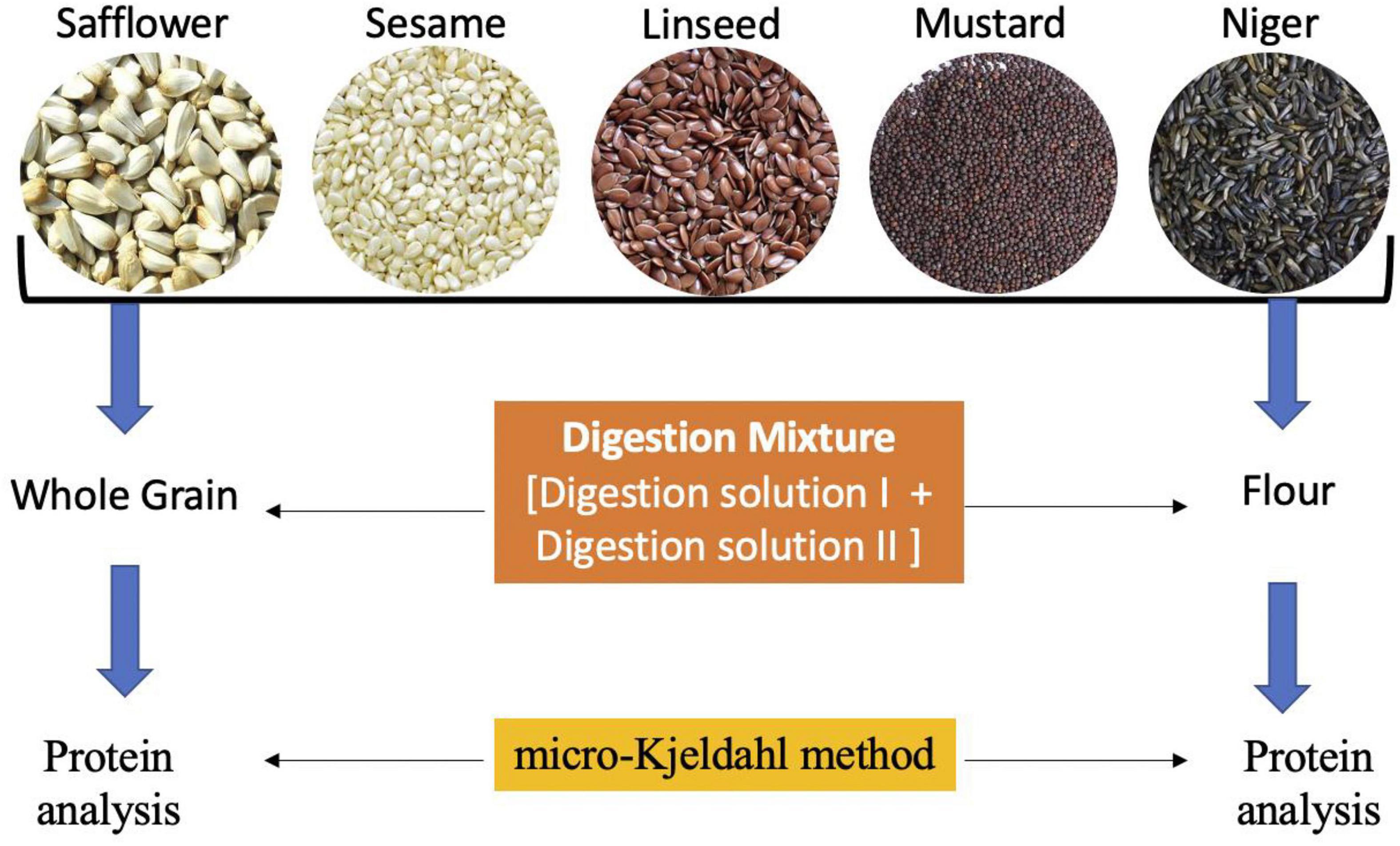
L’analyse Kjeldahl est extrêmement polyvalente, car elle peut traiter une très large gamme d’échantillons provenant de l’alimentation humaine et animale (céréales, viande, poisson, lait, produits laitiers, fruits, légumes), des boissons, de l’environnement (agriculture, oléagineux, sol, engrais, eau , eaux usées, boues) aux industries chimiques et pharmaceutiques (papier, textile, caoutchouc, plastique, polymère).
TKN dans l’analyse environnementale L’azote total Kjeldahl (TKN) est la somme de l’azote organique, de l’ammoniac (NH3) et de l’ammonium (NH4+) dans l’analyse chimique du sol, de l’eau et des eaux usées. Pour calculer l’azote total (TN), les concentrations de nitrate-N et de nitrite-N sont déterminées et ajoutées à l’azote total de Kjeldahl.
L’azote total Kjeldahl (TKN) est la somme de l’azote organique, de l’ammoniac (NH3) et de l’ammonium (NH4+) dans l’analyse chimique du sol, de l’eau et des eaux usées. Pour calculer l’azote total (TN), les concentrations de nitrate-N et de nitrite-N sont déterminées et ajoutées à l’azote total de Kjeldahl.
Aujourd’hui, l’azote total Kjeldahl est un paramètre requis pour les rapports réglementaires dans de nombreuses usines de traitement de l’eau.
TKN et protéines
L’azote total Kjeldahl est utilisé comme substitut des protéines dans les échantillons alimentaires. La conversion de TKN en protéine dépend du type de protéine présente dans l’échantillon et de la fraction de la protéine composée d’acides aminés azotés.
Cependant, la gamme des facteurs de conversion est relativement étroite. Les exemples de facteurs de conversion, appelés facteurs N, pour les aliments vont de 6,38 pour les produits laitiers et 6,25 pour la viande, les œufs et le maïs à 5,70 pour la farine de blé et 5,46 pour les arachides.
Le secret d’une détermination correcte du TKN
Dans la plupart des cas, la clé d’une analyse Kjeldahl réussie peut être l’étape de préparation de l’échantillon (avant la phase de digestion). Cette méthode n’est peut-être pas la méthode la plus rapide à utiliser, mais grâce à sa grande fiabilité, elle donnera toujours des résultats satisfaisants si elle est effectuée correctement (et en suivant les normes).
Principe de fonctionnement de l’analyse d’azote Kjeldahl
Digestion : Décomposition de l’azote dans des échantillons organiques à l’aide d’une solution acide concentrée. Ceci est accompli en faisant bouillir un échantillon homogène dans de l’acide sulfurique concentré. Le résultat final est une solution de sulfate d’ammonium.
Distillation :Ajout d’un excès de base au mélange de digestion acide pour convertir NH4+ en NH3, suivi de l’ébullition et de la condensation du gaz ammoniac NH3 dans une solution réceptrice .  La digestion de Kjeldahl convertit les composés azotés en composés ammoniacaux
La digestion de Kjeldahl convertit les composés azotés en composés ammoniacaux
Titrage : Pour quantifier la quantité d’ammoniac dans la solution réceptrice . La quantité d’azote dans un échantillon peut être calculée à partir de la quantité quantifiée d’ions ammoniac dans la solution réceptrice.  Distillation et titrage
Distillation et titrage
Aujourd’hui, diverses associations scientifiques approuvent la méthode Kjeldahl, dont l’AOAC International (Association of Official Analytical Chemists), l’AACC (Association of American Cereal Chemists), l’AOCS (American Oil Chemists Society), l’EPA (Environmental Protection Agency), l’ISO (International Standards Organisation), et bien d’autres. Tous les équipements VELP Scientifica pour la détermination de l’azote Kjeldahl fonctionnent conformément aux associations mentionnées ci-dessus.
La phase de digestion
La digestion de Kjeldahl convertit les composés azotés en composés ammoniacaux
Le but de la digestion est de briser les liaisons qui maintiennent les polypeptides ensemble et de les convertir en molécules plus simples (telles que l’eau, le dioxyde de carbone et le sulfate d’ammonium). Ces réactions peuvent être accélérées par la température utilisée lors de la digestion Kjeldahl(plus la température utilisée est élevée, plus la digestion peut être obtenue rapidement) et par la présence d’acide, de sel et de catalyseurs (sélénium, cuivre, titane). Les vapeurs qui s’échappent des tubes sont aspirées à travers la ventouse par une pompe à vide à recirculation d’eau JP et éliminées dans un épurateur SMS. Cette configuration optimise l’efficacité de l’opération. Évitez d’utiliser des unités de minéralisation Kjeldahl sans système d’échappement : cela réduira considérablement leur durée de vie et pourrait causer des dommages coûteux. C’est l’étape la plus chronophage de l’analyse.
Pesez votre échantillon
Si l’échantillon est solide, pesez environ 1 à 3 g de l’échantillon dans une nacelle de pesée VELP (sans azote) (CM0486000 ou CM0486001) et enregistrez le poids (la taille des particules de l’échantillon doit être réduite à < 1 mm, pour de meilleurs résultats. Il peut être nécessaire d’homogénéiser l’échantillon, avant toute opération). Si l’échantillon est liquide, mesurez le volume avec une pipette et placez-le dans un bécher et remuez-le à l’aide d’un des agitateurs à plaque chauffante de VELP. Si nécessaire, éliminez tout CO2 (par ex. boissons gazeuses) avant de mesurer le volume.
Si l’échantillon est liquide, mesurez le volume avec une pipette et placez-le dans un bécher et remuez-le à l’aide d’un des agitateurs à plaque chauffante de VELP. Si nécessaire, éliminez tout CO2 (par ex. boissons gazeuses) avant de mesurer le volume.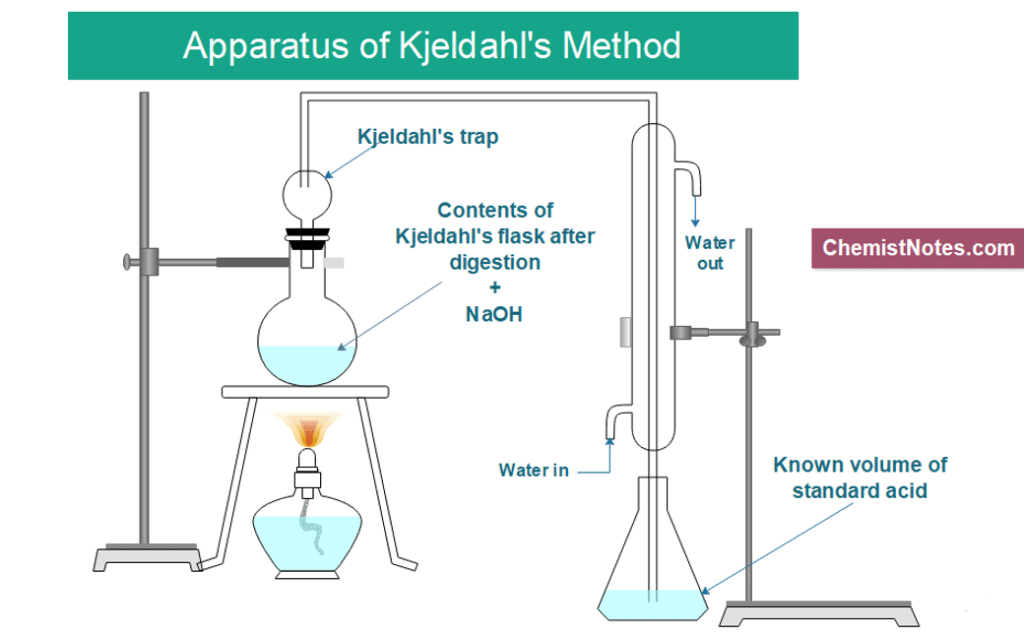 Ajouter l’échantillon, l’acide et le catalyseur dans le tube à essai Placer l’échantillon dans le tube à essai en verre VELP le plus approprié avec 12 à 20 ml d’ acide sulfurique concentré , comme spécifié dans la méthode. La quantité totale d’acide nécessaire lors de la digestion Kjeldahl peut varier d’un type d’échantillon à l’autre. Un autre facteur à considérer est la perte d’acide qui se produit en raison de l’évaporation à travers le système d’échappement utilisé. Le système d’échappement VELP et le bouclier thermique contrôlent la perte d’acide (environ 1,2 ml d’acide par échantillon). Ajouter les comprimés de catalyseur KjTabs TM conformément aux exigences des méthodes officielles. Cuivreles catalyseurs sont satisfaisants mais très lents à réagir. Les catalyseurs au sélénium réagissent généralement très rapidement et sont généralement utilisés pour les substances qui résistent à la digestion de Kjeldahl (par exemple les graisses et les huiles).
Ajouter l’échantillon, l’acide et le catalyseur dans le tube à essai Placer l’échantillon dans le tube à essai en verre VELP le plus approprié avec 12 à 20 ml d’ acide sulfurique concentré , comme spécifié dans la méthode. La quantité totale d’acide nécessaire lors de la digestion Kjeldahl peut varier d’un type d’échantillon à l’autre. Un autre facteur à considérer est la perte d’acide qui se produit en raison de l’évaporation à travers le système d’échappement utilisé. Le système d’échappement VELP et le bouclier thermique contrôlent la perte d’acide (environ 1,2 ml d’acide par échantillon). Ajouter les comprimés de catalyseur KjTabs TM conformément aux exigences des méthodes officielles. Cuivreles catalyseurs sont satisfaisants mais très lents à réagir. Les catalyseurs au sélénium réagissent généralement très rapidement et sont généralement utilisés pour les substances qui résistent à la digestion de Kjeldahl (par exemple les graisses et les huiles).
Réglez le programme dans le digesteur
Les rampes de température et de temps sont essentielles pour l’étape de digestion correcte et nous vous suggérons fortement de suivre les méthodes officielles. Dans la plupart des méthodes, il y a 2 ou 3 rampes de température à régler.
Sélectionnez le programme dans le menu de l’unité de minéralisation Kjeldahl (sur les DKL, les applications les plus utilisées sont préinstallées et d’autres sont programmables par l’utilisateur). En appuyant simplement sur Menu, Programmes, vous pouvez choisir le programme standard à sélectionner ou créer un nouveau programme personnalisable.
Descendez les échantillons (automatiquement sur les unités de digestion DKL Kjeldahl) dans le bloc chauffant en aluminium (sans entretien et très durable) et chauffez le mélange à la température indiquée dans la méthode standard. (Le bloc chauffant en aluminium DKL assure la meilleure homogénéité possible sur tous les tubes et complète la digestion Kjeldahl dans chaque tube. Il peut atteindre 450 °C / 842 °F, assurant une récupération d’azote supérieure à 99 % dans les étapes suivantes). Minéralisation et refroidissement
Minéralisation et refroidissement
Chauffer le mélange pendant le temps indiqué dans la méthode standard afin d’obtenir une solution limpide et incolore . Au cours de cette phase, l’acide sulfurique réagit avec l’échantillon, convertissant tout l’azote sous forme organique en une forme inorganique stable et prête à être analysée.
H 2 SO 4 + N organique →(NH 4 )2SO 4 + CO 2 + H 2 O + autres composés
Si un problème survient lors de la digestion Kjeldahl et/ou si la préparation de l’échantillon n’a pas été correcte, le client peut remarquer la présence de résidus de carbone (de couleur brun noir) dans le mélange digéré et sur les parois des tubes. Ce sont des symptômes de minéralisation incomplète de l’échantillon qui ne peut pas être traité davantage.
Remonter les échantillons (automatiquement sur les unités de minéralisation DKL Kjeldahl) et les refroidir par dispersion naturelle. Séparez le capuchon d’aspiration (appuyez sur la flèche vers le haut sur les unités de digestion DKL Kjeldahl) – un bac de récupération doit être introduit sous le capuchon d’aspiration pour recueillir les gouttes d’acide qui pourraient tomber des cloches en verre du capuchon d’aspiration. Maintenant, le support de tubes peut être retiré et les échantillons sont prêts à être déplacés vers la phase de distillation. Distillation et titrage
Distillation et titrage
La distillation convertit l’azote du sulfate d’ammonium (solide) en ammoniac (gaz).
Le sulfate d’ammonium présent dans l’échantillon digéré est converti en gaz ammoniac, chauffé et distillé. Le gaz ammoniac est conduit dans une solution de piégeage d’acide où il se dissout et redevient un ion ammonium piégé. En utilisant la distillation Kjeldahl, les nitrites et les nitrates ne sont pas détectés. Afin de quantifier ces éléments, une réduction de l’échantillon est nécessaire (à l’aide d’un alliage Devarda) avant l’étape de digestion Kjeldahl. Les unités de distillation VELP Kjeldahl offrent différents niveaux d’automatisation, de la distillation d’entrée de gamme à la distillation avec ajout automatique de réactifs et aspiration des résidus, jusqu’au système entièrement automatisé avec titrage colorimétrique intégré.
Les étapes de distillation


Ajouter de l’eau distillée ou déionisée dans le tube à essai contenant l’échantillon digéré pour le diluer (automatiquement sur les unités de distillation Kjeldahl UDK 139 et UDK 149 et l’analyseur Kjeldahl automatique UDK 159). De cette façon, il est plus facile de détecter tout l’ammoniac.
Séparer l’azote du mélange digéré par distillation à la vapeur (régulation du débit de vapeur 10-100 % sur les unités de distillation Kjeldahl UDK 139 et UDK 149 et l’analyseur Kjeldahl automatique UDK 159), afin d’extraire l’ammoniac de la solution alcaline.
Augmentez le pH du mélange digéré à l’aide d’hydroxyde de sodium (35 %) (automatiquement sur les unités de distillation UDK Kjeldahl) pour convertir le NH4+ (sous forme solide) en NH3 (gazeux), qui sera détecté par titrage. 
Récupération d’ammoniac dans la solution réceptrice
Piège les vapeurs distillées dans une solution dédiée de 25-30 ml d’ acide borique Vreciver TM (automatiquement sur l’unité de distillation Kjeldahl UDK 149 et l’analyseur Kjeldahl automatique UDK 159) pour piéger tout l’azote, éliminant ainsi le risque de perte .
(NH 4 )2SO 4 + 2NaOH → 2NH 3 + Na 2 SO 4 + 2H 2 O
NH 3 + H 3 BO 3 → NH 4 H 2 BO 3 + H 3 BO 3
Vider le tube à essai avec l’échantillon digéré (automatiquement sur les unités de distillation UDK 139 et UDK 149 Kjeldahl et l’analyseur automatique UDK 159 Kjeldahl). 
2 NH 4 H 2 BO 3 + H 2 SO 4 → (NH 4 )2SO 4 + 2H 3 BO 3
Titrage colorimétrique automatique (UDK 159, UDK 169)
VELP Vreceiver™ est une formule certifiée composée de poudre d’acide borique et d’un mélange d’indicateurs mentionnés par les méthodes AOAC ( vert de bromocrésol et rouge de méthyle ) permettant une préparation rapide et standardisée de la solution réceptrice pour le titrage colorimétrique.
La couleur est rouge en l’absence d’ammoniac, vire au vert en cas de quantité importante et gris/rose en fin d’analyse. 
Mettre une solution standardisée (titrant) d’acide chlorhydrique (HCl) ou d’acide sulfurique (H2SO4) dans la burette ; cette solution sera ajoutée (automatiquement) à l’acide borique coloré contenant l’ammoniac distillé à partir de l’échantillon. L’acide réagit avec l’ammoniac afin de le mesurer.
Enregistrez le volume de la solution de titrant acide qui était nécessaire pour atteindre le point final et effectuez un calcul final pour trouver la quantité d’azote, exprimée en % N ou % protéines, dans l’échantillon d’origine (automatiquement).
Titrage avec un titrateur potentiométrique externe (UDK 149)
La burette du titrateur ajoute automatiquement la solution titrante acide à la solution d’acide borique contenant l’ammoniaque distillée, jusqu’à atteindre le point final, correspondant à pH=4,7. 
Dans ce cas, nous ne vérifions pas un changement de couleur et nous n’utilisons pas d’indicateurs, mais nous suivons le changement correspondant du pH de la solution d’acide borique pendant le processus de titrage à l’aide d’un titrateur potentiométrique externe avec une électrode de pH.
Anniversaire historique de la bière : Johan Kjeldahl Aujourd’hui est l’anniversaire de Johan Gustav Christoffer Thorsager Kjeldahl (16 août 1849-18 juillet 1900) C’était un chimiste danois qui a développé une méthode pour déterminer la quantité d’azote dans certains composés organiques en utilisant une technique de laboratoire qui a été nommée la méthode Kjeldahl après lui.
Aujourd’hui est l’anniversaire de Johan Gustav Christoffer Thorsager Kjeldahl (16 août 1849-18 juillet 1900) C’était un chimiste danois qui a développé une méthode pour déterminer la quantité d’azote dans certains composés organiques en utilisant une technique de laboratoire qui a été nommée la méthode Kjeldahl après lui.
Kjeldahl a travaillé à Copenhague au laboratoire Carlsberg, associé à la brasserie Carlsberg, où il a dirigé le département de chimie de 1876 à 1900.
Il a été chargé de déterminer la quantité de protéines dans le grain utilisé dans l’industrie du malt. Moins de protéines signifiait plus de bière. Kjeldahl a trouvé que la réponse était de développer une technique pour déterminer l’azote avec précision, mais les méthodes existantes en chimie analytique liées aux protéines et à la biochimie à l’époque étaient loin d’être précises.
La méthode consiste à chauffer une substance avec de l’acide sulfurique, qui décompose la substance organique par oxydation pour libérer l’azote réduit sous forme de sulfate d’ammonium. Dans cette étape, du sulfate de potassium est ajouté pour augmenter le point d’ébullition du milieu (de 337 °C à 373 °C). La décomposition chimique de l’échantillon est complète lorsque le milieu initialement très foncé est devenu limpide et incolore. La solution est ensuite distillée avec une petite quantité d’hydroxyde de sodium, qui convertit le sel d’ammonium en ammoniaque. La quantité d’ammoniac présente, et donc la quantité d’azote présente dans l’échantillon, est déterminée par titrage en retour. L’extrémité du condenseur est plongée dans une solution d’acide borique. L’ammoniac réagit avec l’acide et le reste de l’acide est alors titré avec une solution de carbonate de sodium au moyen d’un indicateur de pH méthyl orange.
La solution est ensuite distillée avec une petite quantité d’hydroxyde de sodium, qui convertit le sel d’ammonium en ammoniaque. La quantité d’ammoniac présente, et donc la quantité d’azote présente dans l’échantillon, est déterminée par titrage en retour. L’extrémité du condenseur est plongée dans une solution d’acide borique. L’ammoniac réagit avec l’acide et le reste de l’acide est alors titré avec une solution de carbonate de sodium au moyen d’un indicateur de pH méthyl orange.
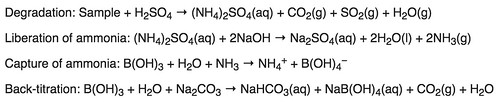
 Kjeldahl (au centre) dans son laboratoire.
Kjeldahl (au centre) dans son laboratoire.
La méthode Kjeldahl pour la détermination de l’azote et des protéines

L’avantage particulier est la versatilité des matrices à analyser. Par exemple, en plus des céréales , des aliments pour animaux , des produits laitiers ou d’autres denrées alimentaires , les lisiers, les boues d’épuration, les composts et les sols ainsi que les extraits aqueux et les eaux usées peuvent également être analysés pour leur teneur en azote. En particulier avec des matériaux d’échantillons très inhomogènes, il n’y a pratiquement pas d’alternative à Kjeldahl en raison des poids d’échantillon élevés.
Dans l’application traditionnelle, des appareils de chauffage manuels de laboratoire sont utilisés, ainsi que des ballons à fond rond pour la digestion et des flacons Erlenmeyer pour la distillation. Après la publication de la méthode Kjeldahl, C. Gerhardt s’est fixé comme objectif d’optimiser cette application classique. Au cours des dernières décennies, un grand nombre de types d’instruments différents ont été développés à cette fin. Tout a commencé avec de grandes crémaillères en fonte ; aujourd’hui, il existe des unités de digestion en bloc très précises et des unités de distillation à la vapeur avec calcul des résultats et alimentation automatique des échantillons.
Cependant, l’analyse de Kjeldahl peut encore être divisée en 3 étapes de travail qui forment également la base de l’application classique :
Digestion des échantillons avec de l’acide sulfurique
Distillation de la solution de digestion à la vapeur
Titrage du distillat et calcul du résultat
La chimie n’a donc que peu changé, mais l’ensemble du processus est désormais entièrement automatisé et adapté aux conditions des laboratoires modernes. L’utilisation d’un bloc de digestion et d’un système de distillation à la vapeur avec titrage intégré présente de nombreux avantages pour l’utilisateur.
Le travail quotidien du personnel du laboratoire est beaucoup plus sûr, car le temps passé devant l’équipement a été réduit et il est équipé de divers dispositifs de sécurité. De plus, le débit d’échantillons a été considérablement augmenté par les processus automatisés. Dans le même temps, la sécurité de l’analyse est également augmentée.
Pour une meilleure compréhension du fonctionnement de l’analyse Kjeldahl avec les systèmes d’analyse automatisés, un schéma expliquant le processus étape par étape est donné ci-dessous :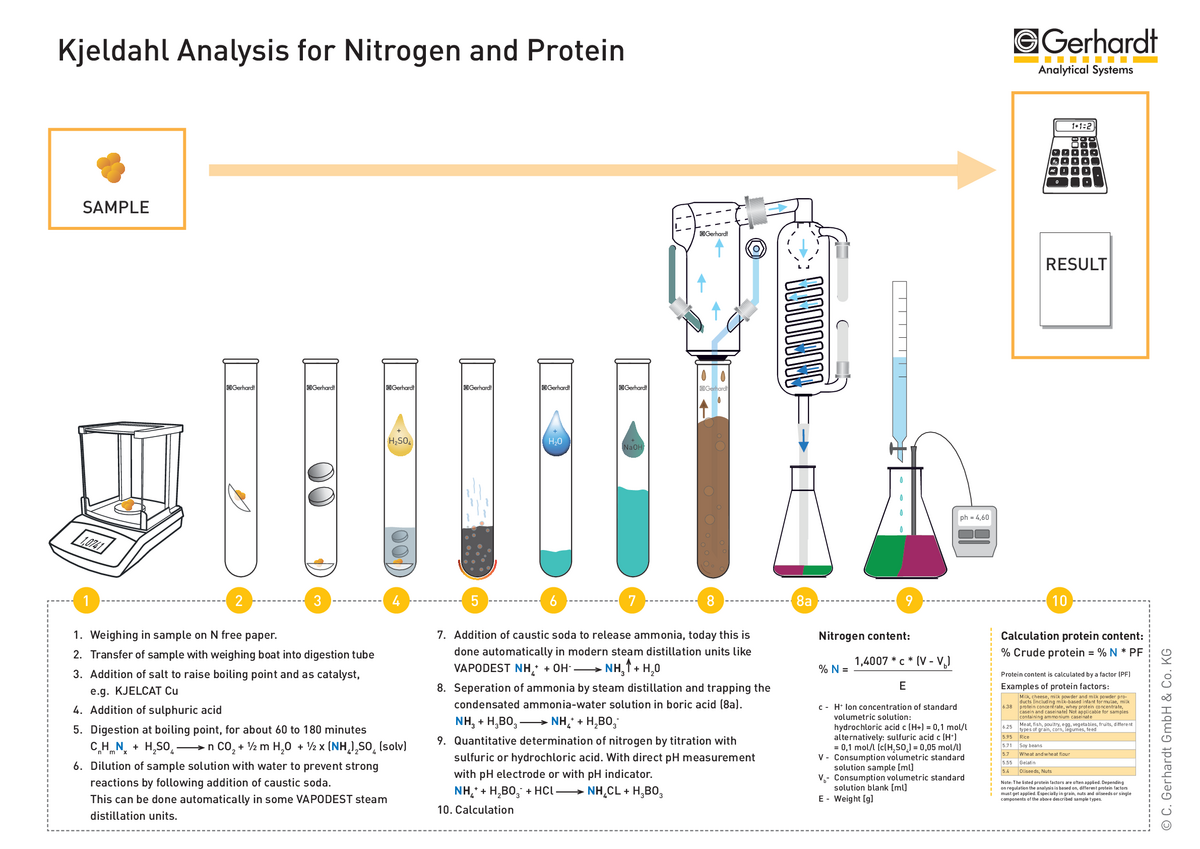 L’automatisation de l’analyse de Kjeldahl
L’automatisation de l’analyse de Kjeldahl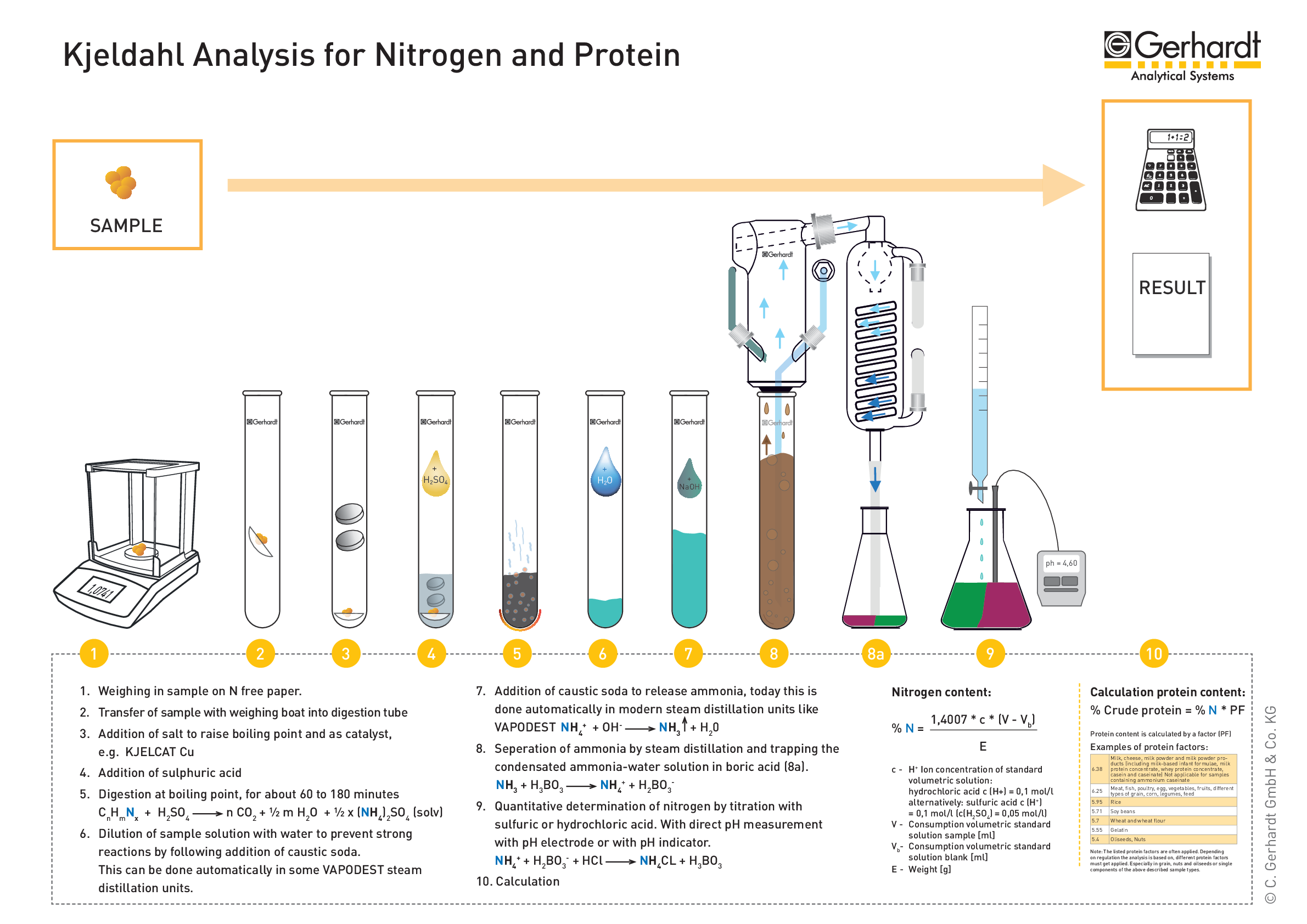 Azote total Kjeldahl vs azote total
Azote total Kjeldahl vs azote total
Les deux termes azote Kjeldahl (Total Kjeldahl Nitrogen, TKN) et azote total (Total N) sont souvent confondus ou même considérés comme identiques, mais ils représentent des valeurs différentes lors de la détermination de la teneur en azote.
Les différents noms conduisent souvent à l’hypothèse que TKN et Total N sont deux formes différentes d’un composé azoté. En fait, cependant, les deux termes décrivent des paramètres de somme différents dans l’analyse de l’azote .
Alors que TKN décrit la proportion d’azote organique lié total et d’ammonium (NH 4 ) dans un échantillon, le N total comprend en outre le nitrite (NO 2 ) et le nitrate (NO 3 ).
Le terme Azote Total Kjeldahl (TKN) ou azote Kjeldahl ne dérive donc pas d’un composé azoté spécifique, mais de la méthode d’analyse utilisée : en d’autres termes, la méthode Kjeldahl.
Étant donné que la méthode de Kjeldahl peut être utilisée pour déterminer non seulement l’azote de Kjeldahl, mais également l’azote ammoniacal (NH 4 ), l’azote nitrite (NO 2 ) et l’azote nitrique (NO 3 ), il est également possible de déterminer les deux paramètres de somme TKN et N total en plus des composés azotés individuels. Les différentes valeurs sont pertinentes pour différents domaines analytiques :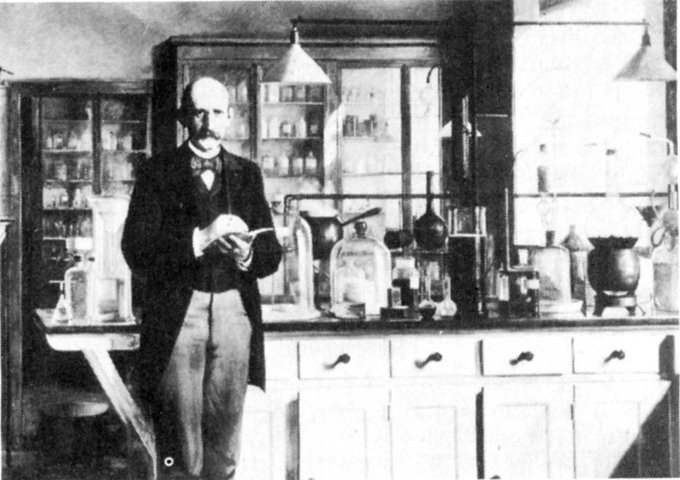
L’azote Kjeldahl est particulièrement pertinent dans le cadre du traitement des eaux usées, car la détermination du TKN est obligatoire dans de nombreuses réglementations internationales. Au cours des différentes étapes du processus, par exemple dans le cadre du traitement biologique des eaux usées, le paramètre est surveillé en permanence. Cela signifie que l’ensemble du processus peut toujours être surveillé pour la qualité et ajusté si nécessaire. La teneur en protéines peut également être calculée à partir de l’azote Kjeldahl contenu dans l’échantillon (voir section Protéines).
Azote ammoniacal
L’azote qui pénètre dans l’environnement via les excrétions et la décomposition de la matière organique est initialement présent principalement sous la forme d’azote organiquement lié. Lors de la minéralisation, celui-ci est converti en ammonium (NH 4 ) dans la première étape. En termes techniques, ce processus est également appelé « ammonification ». Par la suite, l’ammonium est converti en nitrate (NO 3 ) via l’étape intermédiaire de nitrite (NO 2 ), c’est ce qu’on appelle la nitrification.
La minéralisation est un processus naturel qui se produit dans le sol lorsque l’azote est extrait de composés organiques complexes qui ne sont pas disponibles pour les plantes et converti en une espèce d’azote minéral.
Cependant, ce procédé est également utilisé dans l’analyse environnementale, par exemple dans les stations d’épuration lors du traitement des eaux usées, car l’eau est ainsi purifiée. Dans l’eau potable, par exemple, l’indice d’ammonium renseigne sur le degré de pollution de l’eau.
L’ammonium est également pertinent pour l’agriculture, car l’azote contenu dans ce composé peut être absorbé et transformé par les plantes. Comme il a un effet positif sur la croissance des plantes dans les champs, les zones agricoles sont traitées avec des engrais. De l’azote ammoniacal rapidement disponible est ainsi ajouté aux plantes.
Nitrate d’azote.
Semblable à l’azote ammoniacal (NH 4 ), l’azote nitrique (NO 3 ) est également particulièrement bien absorbé par les plantes et favorise leur croissance. Les engrais à base de nitrate sont utilisés dans l’agriculture moderne pour une utilisation plus efficace des terres agricoles disponibles.
Cependant, comme le nitrate n’est inoffensif pour la santé que jusqu’à certaines quantités, il existe des limites strictes dans le monde entier pour l’eau potable, par exemple. L’excès de nitrate peut pénétrer dans les eaux souterraines et d’autres plans d’eau en raison d’une fertilisation excessive des terres agricoles. Par conséquent, dans les zones d’agriculture intensive, le respect des valeurs limites doit être contrôlé régulièrement.
Protéine (calculée avec le facteur protéique)
La détermination de la teneur en protéines est particulièrement pertinente pour les denrées alimentaires et les aliments pour animaux. L’azote organiquement lié (par exemple dans les acides aminés, les protéines, les acides nucléiques (ADN), …) joue un rôle central dans la structure et le métabolisme des organismes vivants.
Étant donné que dans la plupart des aliments, on peut supposer que l’azote Kjeldahl provient principalement des protéines, la teneur en azote d’un échantillon est directement liée à la teneur en protéines. Pour la plupart des échantillons, la teneur en azote des protéines est de 16 %, d’où un facteur de conversion de 6,25 (teneur en azote [%] * facteur protéique = teneur en protéines [%]). Cependant, pour certains échantillons, la proportion diffère, ce qui entraîne un facteur protéique différent (voir tableau ci-dessous).
Facteur protéique (exemples)
Lait 6,25
Viande 6,25
Céréales (sauf blé) 6,25
Blé 5,7
Johann Kjeldahl (1849-1900)
Johann Gustav Christoffer Kjeldahl qui est à l’origine de la méthode Kjeldahl pour la détermination en laboratoire de la teneur en azote des composés organiques. Cela était d’une grande valeur pour les applications dans l’agriculture, la médecine et la fabrication de médicaments. Il a remplacé l’ancienne procédure qui était inexacte et chronophage, et reste en usage jusqu’à présent. De 1876 jusqu’à sa mort, il fut le directeur du laboratoire Carlsberg (une institution de recherche de la brasserie Carslberg). Il a développé sa méthode de mesure de la teneur en azote pour étudier la quantité de protéines dans le grain, ce qui était pertinent pour la transformation des protéines pendant la fermentation de la bière. La méthode a été signalée à la Chemical Society of Copenhagen le 7 mars 1883.
https://brookstonbeerbulletin.com/historic-beer-birthday-johan-kjeldahl/
https://www.gerhardt.de/en/know-how/analytical-methods/kjeldahl-method/
https://www.velp.com/en-ww/kjeldahl-distillation.aspx
https://www.velp.com/en-ww/kjeldahl-digestion.aspx

