Une feuille de route pour les biomarqueurs sériques du virus de l’hépatite B : état des lieux et perspectives d’avenir
Une feuille de route pour les biomarqueurs sériques du virus de l’hépatite B : état des lieux et perspectives d’avenir Utilisation actuelle et future de la « tache de sang séché » analyses en chimie clinique
Utilisation actuelle et future de la « tache de sang séché » analyses en chimie clinique Résumé : L’analyse du sang taché et séché sur un une matrice (c.-à-d. « tache de sang séché » ou DBS) a été utilisée depuis les années 1960 en chimie clinique ; principalement pour le nouveau-né dépistage. Depuis lors, de nombreux analytes cliniques, y compris acides nucléiques, petites molécules et lipides, ont été mesuré avec succès à l’aide de DBS. Bien que cette analyse préanalytique approche représente une alternative intéressante au prélèvement sanguin veineux classique, son utilisation en routine est limitée. Ici, nous passons en revue l’application de la technologie DBS dans la chimie clinique, et évaluer son futur rôle soutenu par de nouvelles méthodes analytiques telles que la spectrométrie de masse.
Résumé : L’analyse du sang taché et séché sur un une matrice (c.-à-d. « tache de sang séché » ou DBS) a été utilisée depuis les années 1960 en chimie clinique ; principalement pour le nouveau-né dépistage. Depuis lors, de nombreux analytes cliniques, y compris acides nucléiques, petites molécules et lipides, ont été mesuré avec succès à l’aide de DBS. Bien que cette analyse préanalytique approche représente une alternative intéressante au prélèvement sanguin veineux classique, son utilisation en routine est limitée. Ici, nous passons en revue l’application de la technologie DBS dans la chimie clinique, et évaluer son futur rôle soutenu par de nouvelles méthodes analytiques telles que la spectrométrie de masse.
 Mise en place pour la première fois en Ecosse, cette utilisation du DBS s’est propagée au Royaume-Uni dans les années 1970, principalement pour détecter d’éventuelles erreurs innées du métabolisme qui pouvaient être traitées. Il est à noter que l’utilisation du DBS reste presque exclusivement limitée à ce type de dépistage néonatal, même si de nombreuses études démontrent son application potentielle en biologie clinique, ainsi qu’en recherche. En effet, les méthodes classiques de chimie clinique, d’analyse des petites molécules et des lipides ou les approches de biologie moléculaire, sont toutes parfaitement adaptées à l’utilisation de la DBS.
Mise en place pour la première fois en Ecosse, cette utilisation du DBS s’est propagée au Royaume-Uni dans les années 1970, principalement pour détecter d’éventuelles erreurs innées du métabolisme qui pouvaient être traitées. Il est à noter que l’utilisation du DBS reste presque exclusivement limitée à ce type de dépistage néonatal, même si de nombreuses études démontrent son application potentielle en biologie clinique, ainsi qu’en recherche. En effet, les méthodes classiques de chimie clinique, d’analyse des petites molécules et des lipides ou les approches de biologie moléculaire, sont toutes parfaitement adaptées à l’utilisation de la DBS. 

Procédure générale DBS – Collecte et échantillonnage La zone de prélèvement (doigt, talon) doit d’abord être désinfectée. La peau est ensuite ponctionnée avec une lancette stérile (Figure 1). La première goutte de sang est tamponnée et les gouttes suivantes sont placées sur du papier buvard marqué de cercles à remplir. Une fois tous les cercles requis remplis, le papier buvard est laissé sécher quelques heures à température ambiante sur une surface non absorbante. Le temps de séchage est très importante car l’humidité résiduelle favorise le développement de bactéries ou de moisissures et modifie l’étape d’extraction. Conservation Une fois sèches, les cartes DBS sont placées dans un sac plastique étanche, éventuellement accompagné d’un déshydratant et d’un indicateur d’humidité.
La zone de prélèvement (doigt, talon) doit d’abord être désinfectée. La peau est ensuite ponctionnée avec une lancette stérile (Figure 1). La première goutte de sang est tamponnée et les gouttes suivantes sont placées sur du papier buvard marqué de cercles à remplir. Une fois tous les cercles requis remplis, le papier buvard est laissé sécher quelques heures à température ambiante sur une surface non absorbante. Le temps de séchage est très importante car l’humidité résiduelle favorise le développement de bactéries ou de moisissures et modifie l’étape d’extraction. Conservation Une fois sèches, les cartes DBS sont placées dans un sac plastique étanche, éventuellement accompagné d’un déshydratant et d’un indicateur d’humidité.  Le déshydratant a pour but de finaliser le processus de séchage, ce qui minimise également tout risque d’infection lié à l’échantillonnage. Les durées de stockage à température ambiante varient selon le facteur biologique, de 1 semaine pour les protéines, à 1 an ou plus pour les acides nucléiques. En ce qui concerne la sérologie, les papiers buvards sont généralement conservés à –20C à réception. Pour une conservation à long terme (jusqu’à plusieurs années), les papiers buvards sont stockés à −20 C ou à –80 C.
Le déshydratant a pour but de finaliser le processus de séchage, ce qui minimise également tout risque d’infection lié à l’échantillonnage. Les durées de stockage à température ambiante varient selon le facteur biologique, de 1 semaine pour les protéines, à 1 an ou plus pour les acides nucléiques. En ce qui concerne la sérologie, les papiers buvards sont généralement conservés à –20C à réception. Pour une conservation à long terme (jusqu’à plusieurs années), les papiers buvards sont stockés à −20 C ou à –80 C. Extraction
Extraction
L’extraction des analytes des échantillons DBS doit être réalisée en utilisant une procédure standard. Un ou plusieurs disques de 2 à 8 mm de diamètre sont ensuite créés avec un poinçon spécifique. Ces petits « spots » sont placés dans un tampon d’élution pendant des durées variables selon la procédure. L’extraction DBS est ensuite traitée comme un échantillon de sang total hémolysé et testée avec des méthodes souvent destinées au plasma ou au sérum. Le tampon d’élution joue un rôle majeur dans la resolubilisation des analytes à tester. Une grande variété de tampons sont décrits dans la littérature. Les plus courants sont les tampons salins/phosphates, souvent avec des détergents ajoutés (Tween, Triton…), des protéines porteuses et des chélateurs [acide éthylène diamine tétra acétique (EDTA)], ainsi que des tampons organiques avec du méthanol, de l’acétonitrile ou de l’éthanol. Pour les acides nucléiques, il existe des kits commerciaux standards compatibles avec les tests de biologie moléculaire, de la réaction en chaîne par polymérase (PCR) aux puces génomiques.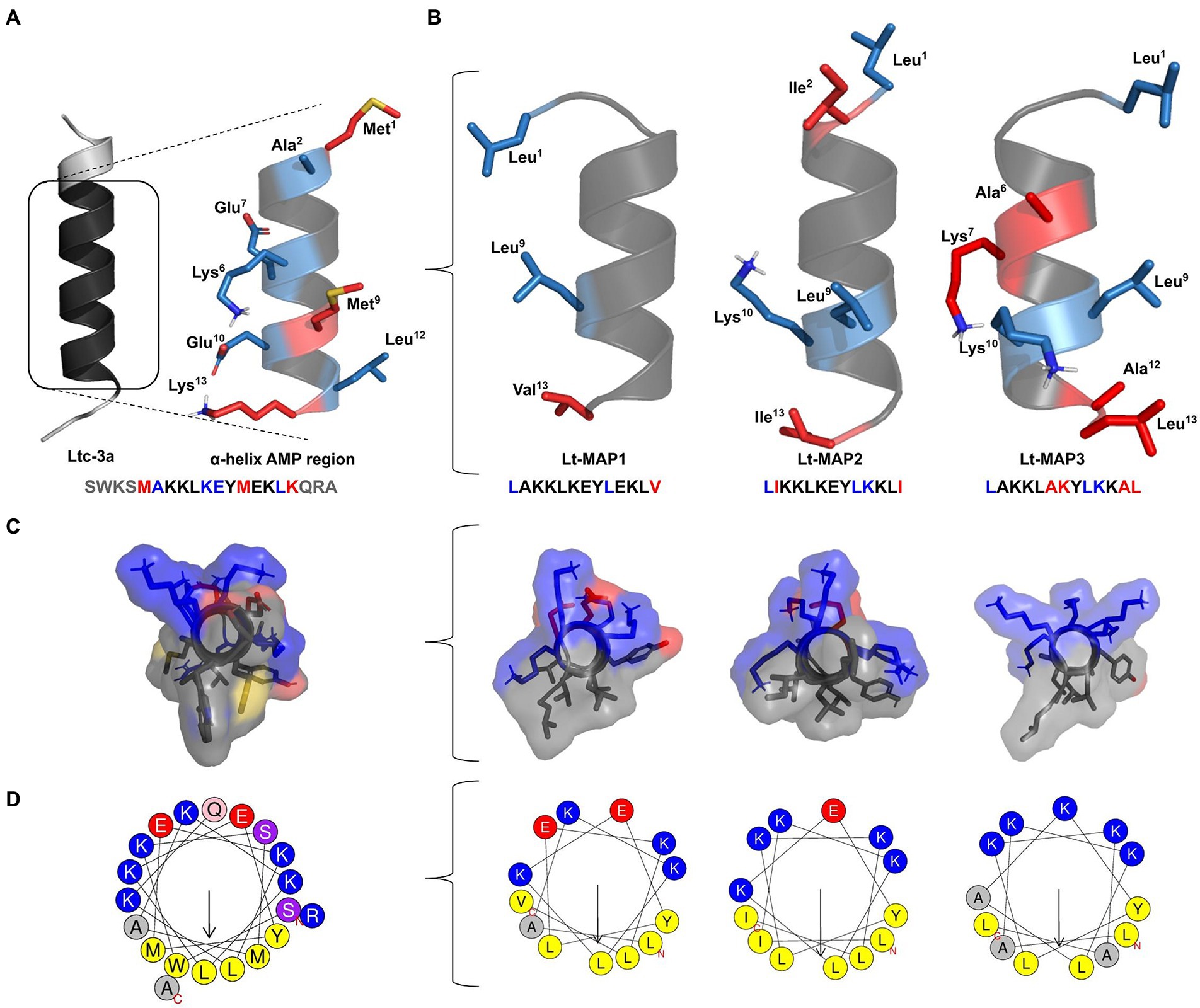 Avantages et inconvénients de la DBS L’un des principaux avantages de l’utilisation de la technologie DBS est qu’elle permet d’accéder aux échantillons dans des situations pré-analytiques où le prélèvement sanguin standard est difficile (problème de prélèvement, de stockage). Le DBS typique contient environ 50 μL de sang total sur une surface moyenne de 12 mm². Il permet de tester divers analytes tels que les acides nucléiques, les protéines, les lipides ou les petites molécules organiques et non organiques (tableau 1). Deux types de DBS sont principalement disponibles : des filtres en papier coton de différentes qualités (Whatmann 903 Protein Saver Cards Whatmann, Springfield Mill, UK ; Perkin Elmer 226 Spot Saver Card, Perkin Elmer, Waltham, USA) et des papiers filtres en microfibre de verre (Agilent Bond Elut DMS, Santa Clara, Californie, États-Unis ; Filtres en microfibre de verre Sartorius, Goettingen, Allemagne).
Avantages et inconvénients de la DBS L’un des principaux avantages de l’utilisation de la technologie DBS est qu’elle permet d’accéder aux échantillons dans des situations pré-analytiques où le prélèvement sanguin standard est difficile (problème de prélèvement, de stockage). Le DBS typique contient environ 50 μL de sang total sur une surface moyenne de 12 mm². Il permet de tester divers analytes tels que les acides nucléiques, les protéines, les lipides ou les petites molécules organiques et non organiques (tableau 1). Deux types de DBS sont principalement disponibles : des filtres en papier coton de différentes qualités (Whatmann 903 Protein Saver Cards Whatmann, Springfield Mill, UK ; Perkin Elmer 226 Spot Saver Card, Perkin Elmer, Waltham, USA) et des papiers filtres en microfibre de verre (Agilent Bond Elut DMS, Santa Clara, Californie, États-Unis ; Filtres en microfibre de verre Sartorius, Goettingen, Allemagne). 
 Virus T-lymphotrope (HTLV)] réduisant tout risque éventuel de contamination pour le personnel médical ou paramédical. De plus, il permet l’envoi d’échantillons par courrier ordinaire sans risque particulier de contamination. Cela représente un atout précieux pour l’échantillonnage dans les communautés éloignées, soit situées loin d’un laboratoire d’analyse, soit avec une infrastructure technique limitée disponible, apporte donc une valeur ajoutée par rapport à l’échantillonnage sanguin standard. Par sa petite taille et sa capacité d’empilement, DBS est également une solution précieuse pour réduire et faciliter le stockage dans les laboratoires cliniques et les biobanques. Il est à noter qu’en cas de stockage, un ensachage individuel ou une séparation à l’aide d’un papier résistant sera important pour éviter la possibilité de contamination croisée entre les cartes.
Virus T-lymphotrope (HTLV)] réduisant tout risque éventuel de contamination pour le personnel médical ou paramédical. De plus, il permet l’envoi d’échantillons par courrier ordinaire sans risque particulier de contamination. Cela représente un atout précieux pour l’échantillonnage dans les communautés éloignées, soit situées loin d’un laboratoire d’analyse, soit avec une infrastructure technique limitée disponible, apporte donc une valeur ajoutée par rapport à l’échantillonnage sanguin standard. Par sa petite taille et sa capacité d’empilement, DBS est également une solution précieuse pour réduire et faciliter le stockage dans les laboratoires cliniques et les biobanques. Il est à noter qu’en cas de stockage, un ensachage individuel ou une séparation à l’aide d’un papier résistant sera important pour éviter la possibilité de contamination croisée entre les cartes.  Ces propriétés du DBS ont été utilisées dans la recherche expérimentale, en facilitant les études pharmacologiques et pharmacocinétiques sur de petits animaux avec des volumes très limités de liquides biologiques. Cela fait suite à la réglementation visant à protéger les petits animaux (diminution du volume des échantillons et sophistication des méthodes d’échantillonnage) lors des études précliniques. Concernant la stabilité des échantillons, de nombreuses études ont montré que la plupart des analytes du sang total sont stables à température ambiante pendant au moins 7 jours. Dans certains cas comme les opiacés, le DBS augmente même la stabilité pendant le stockage, et les acides nucléiques sont un outil majeur pour la conservation à court et à long terme, car ils peuvent être isolés après plusieurs mois à température ambiante et plusieurs années à -20C. D’un point de vue médico-économique, il est intéressant de noter que l’utilisation du DBS permet une réduction significative des coûts en raison de la diminution des besoins en personnel formé, de la facilitation du transport, du stockage et de la transformation.
Ces propriétés du DBS ont été utilisées dans la recherche expérimentale, en facilitant les études pharmacologiques et pharmacocinétiques sur de petits animaux avec des volumes très limités de liquides biologiques. Cela fait suite à la réglementation visant à protéger les petits animaux (diminution du volume des échantillons et sophistication des méthodes d’échantillonnage) lors des études précliniques. Concernant la stabilité des échantillons, de nombreuses études ont montré que la plupart des analytes du sang total sont stables à température ambiante pendant au moins 7 jours. Dans certains cas comme les opiacés, le DBS augmente même la stabilité pendant le stockage, et les acides nucléiques sont un outil majeur pour la conservation à court et à long terme, car ils peuvent être isolés après plusieurs mois à température ambiante et plusieurs années à -20C. D’un point de vue médico-économique, il est intéressant de noter que l’utilisation du DBS permet une réduction significative des coûts en raison de la diminution des besoins en personnel formé, de la facilitation du transport, du stockage et de la transformation. 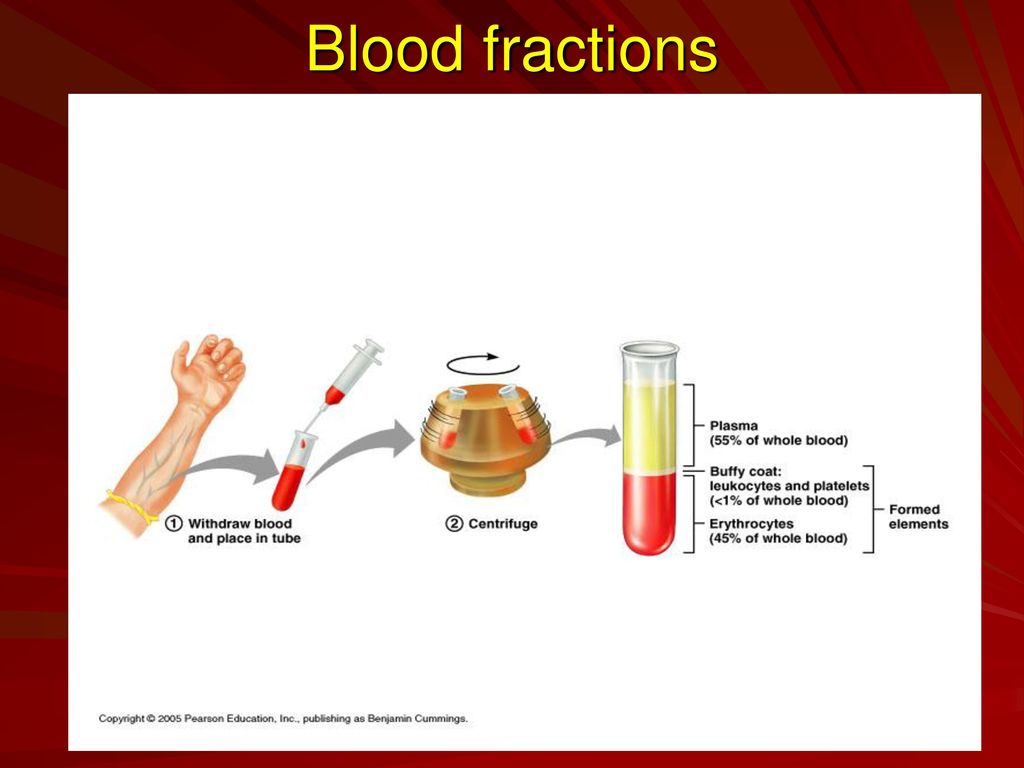 Un inconvénient majeur de la technologie DBS réside dans la nature de l’échantillon biologique lui-même. Dans une procédure d’échantillonnage standard, le sérum ou le plasma est analysé, tandis que les échantillons DBS sont composés de sang total hémolysé. Par conséquent, des interférences dues à l’hémoglobine et à la libération de contenu intracellulaire pourraient se produire. Les cellules sanguines (érythrocytes, leucocytes, plaquettes, etc.) sont altérées par le processus de dessiccation, les tests hématologiques cellulaires sont donc impossibles. Le séchage peut également dénaturer les protéines et altérer l’activité enzymatique des protéines sanguines (aspartate transaminase). Toutes les cellules restantes dans les échantillons peuvent également modifier la composition protéique globale et donc modifier la concentration de certains analytes. Dans certains cas, les seuils cliniques établis à partir d’échantillons sanguins standards doivent être adaptés. L’hématocrite qui affecte la dispersion du sang sur le papier buvard doit également être pris en compte. Le petit volume d’échantillons résultant du DBS peut être un inconvénient pour les tests à faible sensibilité et pour l’exécution de plusieurs tests.
Un inconvénient majeur de la technologie DBS réside dans la nature de l’échantillon biologique lui-même. Dans une procédure d’échantillonnage standard, le sérum ou le plasma est analysé, tandis que les échantillons DBS sont composés de sang total hémolysé. Par conséquent, des interférences dues à l’hémoglobine et à la libération de contenu intracellulaire pourraient se produire. Les cellules sanguines (érythrocytes, leucocytes, plaquettes, etc.) sont altérées par le processus de dessiccation, les tests hématologiques cellulaires sont donc impossibles. Le séchage peut également dénaturer les protéines et altérer l’activité enzymatique des protéines sanguines (aspartate transaminase). Toutes les cellules restantes dans les échantillons peuvent également modifier la composition protéique globale et donc modifier la concentration de certains analytes. Dans certains cas, les seuils cliniques établis à partir d’échantillons sanguins standards doivent être adaptés. L’hématocrite qui affecte la dispersion du sang sur le papier buvard doit également être pris en compte. Le petit volume d’échantillons résultant du DBS peut être un inconvénient pour les tests à faible sensibilité et pour l’exécution de plusieurs tests.
Utilisation de la DBS en chimie clinique 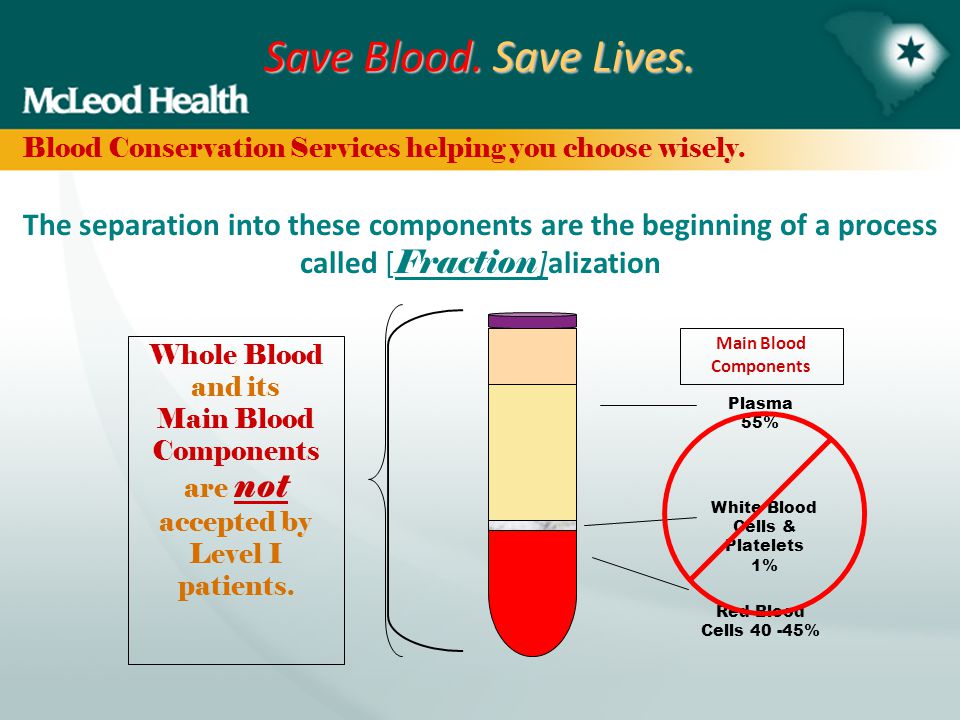 L’utilisation première de la DBS en France est le dépistage néonatal systématique. Le prélèvement sanguin chez les nouveau-nés étant difficile, la technologie DBS représente une alternative viable. Le DBS testing a été mis en place en 1978 par l’Association française de dépistage et de prévention des handicaps chez l’enfant (http://www.afdphe.org/). L’échantillonnage des nouveau-nés permet de détecter la phénylcétonurie, l’hypothyroïdie, l’hyperplasie surrénalienne, la mucoviscidose et la drépanocytose (dans certaines régions). L’extension de ces tests à un plus grand nombre de maladies, comme aux USA, est actuellement à l’étude. Un résultat positif sera toujours confirmé ou infirmé par d’autres tests spécifiques. Au-delà de son utilisation pour le dépistage néonatal, de nombreux analytes cliniques peuvent être mesurés à l’aide de DBS. Ces analytes sont divisés en quatre grandes catégories comme suit (voir également le tableau 1).
L’utilisation première de la DBS en France est le dépistage néonatal systématique. Le prélèvement sanguin chez les nouveau-nés étant difficile, la technologie DBS représente une alternative viable. Le DBS testing a été mis en place en 1978 par l’Association française de dépistage et de prévention des handicaps chez l’enfant (http://www.afdphe.org/). L’échantillonnage des nouveau-nés permet de détecter la phénylcétonurie, l’hypothyroïdie, l’hyperplasie surrénalienne, la mucoviscidose et la drépanocytose (dans certaines régions). L’extension de ces tests à un plus grand nombre de maladies, comme aux USA, est actuellement à l’étude. Un résultat positif sera toujours confirmé ou infirmé par d’autres tests spécifiques. Au-delà de son utilisation pour le dépistage néonatal, de nombreux analytes cliniques peuvent être mesurés à l’aide de DBS. Ces analytes sont divisés en quatre grandes catégories comme suit (voir également le tableau 1).
Acides nucléiques exogènes  La mesure des acides nucléiques est typiquement requise dans le domaine de la virologie. Il existe un intérêt croissant pour le dépistage viral par détection d’acides nucléiques (ARN, ADN) à l’aide de DBS, car les technologies actuelles de biologie moléculaire [réaction en chaîne par polymérase quantitative (Q-PCR), réaction en chaîne par polymérase de transcription inverse (RT-PCR)] sont très sensibles et ne nécessitent qu’une petite quantité d’échantillon (20 μL). Néanmoins, il est important de noter que la quantité de matériel disponible à partir d’un échantillon DBS est inférieure de 1 à 2 logs par rapport à un échantillon standard de sérum ou de plasma. La conservation des acides nucléiques sur papier buvard est stable sur de longues périodes, à condition qu’il soit séché et stocké à l’abri de l’humidité dans une poche plastique adaptée contenant un dessicant. La détection d’acide nucléique DBS est principalement utilisée dans le dépistage de maladies virales telles que le cytomégalovirus, le virus de l’herpès simplex, l’hépatite A, l’hépatite C et le VIH.
La mesure des acides nucléiques est typiquement requise dans le domaine de la virologie. Il existe un intérêt croissant pour le dépistage viral par détection d’acides nucléiques (ARN, ADN) à l’aide de DBS, car les technologies actuelles de biologie moléculaire [réaction en chaîne par polymérase quantitative (Q-PCR), réaction en chaîne par polymérase de transcription inverse (RT-PCR)] sont très sensibles et ne nécessitent qu’une petite quantité d’échantillon (20 μL). Néanmoins, il est important de noter que la quantité de matériel disponible à partir d’un échantillon DBS est inférieure de 1 à 2 logs par rapport à un échantillon standard de sérum ou de plasma. La conservation des acides nucléiques sur papier buvard est stable sur de longues périodes, à condition qu’il soit séché et stocké à l’abri de l’humidité dans une poche plastique adaptée contenant un dessicant. La détection d’acide nucléique DBS est principalement utilisée dans le dépistage de maladies virales telles que le cytomégalovirus, le virus de l’herpès simplex, l’hépatite A, l’hépatite C et le VIH.
Peptides – protéines  Concernant les protéines et les peptides, une mise en garde est représentée par la difficulté relative de leur extraction à partir d’échantillons de DBS, ainsi que la faible sensibilité de certains dosages de protéines. Les principales protéines mesurées à partir du DBS peuvent être classées en deux groupes : les protéines sériques standard et les anticorps.
Concernant les protéines et les peptides, une mise en garde est représentée par la difficulté relative de leur extraction à partir d’échantillons de DBS, ainsi que la faible sensibilité de certains dosages de protéines. Les principales protéines mesurées à partir du DBS peuvent être classées en deux groupes : les protéines sériques standard et les anticorps.
Les techniques analytiques les plus largement utilisées sont les dosages immunologiques qui mesurent les analytes cliniques avec de bonnes spécificités et sensibilités. Un exemple est représenté par le dosage immunotur bidimétrique de l’hémoglobine glyquée (pour surveiller l’équilibre glycémique chez les patients diabétiques). 
 Lipides, sucres et petites molécules
Lipides, sucres et petites molécules
La phénylalanine, un acide aminé mesuré dans le dépistage de la phénylcétonurie des nouveau-nés, illustre le dosage des petites molécules par DBS. Les petites molécules organiques sont nettement moins sensibles que les protéines au processus de séchage qui caractérise les échantillons DBS. De plus, les progrès majeurs de la chromatographie liquide/spectrométrie de masse (LC/MS) dans ce domaine ont permis la quantification de nombreuses petites molécules telles que la vitamine D ou les lipides. Par exemple, des niveaux élevés de triglycérides, représentant un risque important pour les maladies cardiovasculaires et coronariennes, peuvent être quantifiés à l’aide de DBS. Ces analytes restent stables sur DBS pendant 30 jours à température ambiante et jusqu’à 90 jours à 4°C. Le profilage des glycanes sur DBS a également été récemment réalisé en utilisant la spectrométrie de masse. Xénobiotiques
Xénobiotiques
En 1993, Henderson et al. ont démontré l’utilisation de DBS pour détecter des stupéfiants, tels que la cocaïne, en modifiant un kit commercial de radio immunodos Age (RIA). Les tests xénobiotiques utilisant le DBS ont depuis joué un rôle important, principalement par le dépistage des médicaments antipaludéens et antirétroviraux par LC/MS dans des populations isolées. Un autre exemple est représenté par la quantification de neuf molécules antirétrovirales dans le VIH à l’aide de DBS. Cette méthode de détection a été validée par la Food and Drug Administration (FDA) avec une stabilité des échantillons allant de 12 à plus de 90 jours à température ambiante. Dans le domaine de la toxicologie, qui est une application majeure du DBS, Saussereau et al. ont par exemple développé une nouvelle méthode de criblage de drogues basée sur la LC/MS utilisant l’extraction en ligne pour la quantification des opiacés, des cocaïniques ou des amphétamines. Le développement de ces nouvelles techniques de mesure, basées sur la LC/MS pour les xénobiotiques, augmentera fortement l’intérêt de l’utilisation de la DBS en chimie clinique.
Génomique
Le potentiel clinique de la DBS pour la génomique a été démontré dès 1987. La micro-extraction d’ADN à partir de sang séché a permis la détection de mutations responsables de maladies telles que la mucoviscidose, le syndrome de l’X fragile, l’amyotrophie spinale, les cancers et la thalassémie. Le DBS, qui est une méthode d’échantillonnage et de stockage relativement peu coûteuse, est également un bon choix pour les biobanques de matériel génétique. Par exemple, la biobanque nationale danoise pour le dépistage néonatal comprend plus de 2 millions de DBS, ce qui correspond pratiquement à tous les Danois nés depuis 1982.
Conclusions
L’utilisation de DBS présente de nombreux avantages en termes d’échantillonnage, de transport, de stockage et de biosécurité par rapport aux méthodes de collecte classiques. Un aspect intéressant du DBS est la possibilité d’un « prélèvement sanguin auto/domicile » simplifié. Le patient sera en mesure de prélever de manière autonome et en toute sécurité un échantillon de sang. Le DBS sera ensuite envoyé au laboratoire par courrier. Comme décrit dans cette revue, de nombreux analytes cliniques sont déjà disponibles sur DBS, et d’autres suivront, grâce à des approches innovantes. En effet, le développement de la micro fluidique, des systèmes de détection multiplex immunologique/génomique, de la spectrométrie de masse et du traitement DBS automatisé ouvrent de nouvelles perspectives cliniques intéressantes. La détection et le suivi des maladies métaboliques, infectieuses et chroniques pourraient donc s’appuyer sur l’utilisation du DBS. Le patient et la société pourraient bénéficier de cette technologie. Déjà, plusieurs laboratoires publics et commerciaux en Europe et aux États-Unis proposent des kits DBS pour une large gamme d’analytes souvent regroupés en panels pour les maladies hormonales, métaboliques ou cardiovasculaires. Cette évolution pourrait changer radicalement la façon dont les pré-analyses de chimie clinique sont traitées à l’avenir.
Un monde où le sang est devenu possible
Imaginez un monde sans transfusion sanguine. Des millions seraient perdus à cause de la guerre, de la maladie et de la chirurgie simplement parce qu’ils ne pouvaient pas recevoir de sang frais. Sans les recherches menées par deux biochimistes, Staurt Mudd et Earl Flosdorf au début des années 1930 à l’Université de Pennsylvanie, cela aurait pu être le cas. Leurs recherches ont été consacrées au séchage et au conditionnement du sérum sanguin humain, une technique médicale qui a été développée et utilisée pendant la Seconde Guerre mondiale comme moyen de collecter du sang, en particulier aux États-Unis pour l’exporter vers la Grande-Bretagne. Bien que cette technique ait été développée à Philadelphie, son impact a été ressenti dans le monde entier et a été crucial pour sauver des millions de vies pendant la guerre et, aujourd’hui encore, elle est utilisée dans une variété d’applications.
Dans l’une de ses premières applications, le sang séché a été utilisé dans l’agriculture comme engrais au début des années 1900. On a laissé le sang coaguler, puis le sang coagulé a été séparé et séché, il a été pulvérisé et appliqué directement sur le sol. Ce n’est qu’en décembre 1933 que Staurt Mudd, originaire de Bryn Mawr, en Pennsylvanie, et le Dr Earl W. Flosdorf de l’Université de Pennsylvanie ont préparé le premier sang humain séché. Ces méthodes sont restées imparfaites jusqu’aux années 1940, lorsqu’elles sont devenues nécessaires pour les programmes militaires de la Seconde Guerre mondiale. Les découvertes de Flosdorf et Mudd en Pennsylvanie, ainsi que les contributions de Ronald Greaves en Angleterre ont été en grande partie responsables du développement d’applications à grande échelle de la lyophilisation.
Le problème du transport du sang sur de longues distances pour aider à la lutte à l’étranger réside dans le fait que le sang est une composition de nombreuses protéines qui finissent par se décomposer dans des conditions environnementales normales. Les protéines sont la base de tout matériel vivant et la vie elle-même est maintenue par la construction et la rupture de ces molécules. Les protéines biologiques à l’extérieur de l’organisme vivant s’agrègent et deviennent insolubles, une séquence d’événements connue sous le nom de dénaturation. La dénaturation est influencée par le temps et la température, et est un processus variable qui dépend du type de protéine(s) impliquée(s). Le problème avec les techniques de séchage commerciales disponibles dans les années 1930 était que l’application de chaleur détruisait des protéines cruciales dans le sang, en raison de la dénaturation. Par conséquent, différentes méthodes devaient être développées, spécifiquement pour le sang et les matériaux biologiques.
En bref, le procédé développé par Mudd et Flosdorf était une méthode de séchage par sublimation après « congélation par rotation verticale à grande vitesse », suivie d’une dessiccation secondaire. Maintenant, vous vous dites peut-être : « Attendez une minute, sublimation, dessiccation, quoi ?! En termes simples, le sang est séparé en ses composants, congelé et séché deux fois afin qu’il reste moins de 0,5 % d’eau dans l’échantillon de sang. Cette manière de sécher le sang est préférée aux autres méthodes car elle entraîne peu ou pas de dénaturation ou de dégradation des protéines. Cela se produit parce que les protéines sont séchées par sublimation, ou la transition d’un solide directement à un gaz sans passer par la phase liquide intermédiaire.
Lorsque la guerre éclata en 1939, il semblait que la transfusion sanguine jouerait un rôle important dans le traitement des blessés. Le problème était que le sang total, à moins qu’il ne soit donné frais, devait être réfrigéré et, même dans ce cas, ne pouvait être utilisé que pendant un temps limité après le prélèvement. En plus de cela, l’utilisation de sang total pour la transfusion sur le terrain était limitée en raison de la nécessité d’un stockage au froid. Par conséquent, les conditions de guerre exigeaient un dérivé du sang stable, transportable et pouvant être administré à n’importe quel patient.
Les méthodes que Flosdorf et Mudd ont développées à partir d’une curiosité de laboratoire en 1935 et finalement 10 ans plus tard en 1945, sont devenues une procédure réalisable. Les techniques pour réaliser le séchage sous vide poussé par sublimation comportent deux étapes. Dans le premier, la glace est évaporée à partir d’un état congelé. Dans cette étape, la chaleur est introduite très rapidement dans le matériau congelé afin qu’il ne ramollisse pas ou ne fonde pas, ce qui se produirait dans un processus plus lent. En même temps la chaleur introduite va créer du gaz qu’il faudra évacuer avec un flux d’air maximal loin du solide.  Deux méthodes courantes pour effectuer la première étape impliquent la condensation à basse température avec des condenseurs refroidis avec de la neige carbonique ou des réfrigérants tels que le fréon. La deuxième méthode utilise des éjecteurs à vapeur de grande capacité pour le pompage direct et l’évacuation de la vapeur. Les deux méthodes doivent avoir lieu entre -9° et -12°C en ce qui concerne le séchage du sang. Dans la deuxième et dernière étape, l’humidité est éliminée du solide sec final pour réduire davantage la teneur résiduelle. Cette étape est effectuée à -40°C et implique une autre étape de chauffage qui n’est pas aussi stricte dans son exécution que la première étape puisque le reste d’eau évaporée est si petit. Bien que Mudd et Flosdorf aient apporté des contributions majeures au processus, d’autres travaux se déroulaient à l’étranger en même temps.
Deux méthodes courantes pour effectuer la première étape impliquent la condensation à basse température avec des condenseurs refroidis avec de la neige carbonique ou des réfrigérants tels que le fréon. La deuxième méthode utilise des éjecteurs à vapeur de grande capacité pour le pompage direct et l’évacuation de la vapeur. Les deux méthodes doivent avoir lieu entre -9° et -12°C en ce qui concerne le séchage du sang. Dans la deuxième et dernière étape, l’humidité est éliminée du solide sec final pour réduire davantage la teneur résiduelle. Cette étape est effectuée à -40°C et implique une autre étape de chauffage qui n’est pas aussi stricte dans son exécution que la première étape puisque le reste d’eau évaporée est si petit. Bien que Mudd et Flosdorf aient apporté des contributions majeures au processus, d’autres travaux se déroulaient à l’étranger en même temps.
Ronald Greaves a travaillé dans l’unité de séchage du sang à Cambridge, en Angleterre, et a travaillé pour perfectionner le processus de séchage du sang dans une usine pilote, une usine de séchage pour les travaux à grande échelle et les difficultés en temps de guerre. Pour mener à bien ce processus, dans un premier temps, des études sérologiques ont été réalisées sur chaque don de sang. Ensuite, le sang a été séparé des éléments cellulaires dans des centrifugeuses. Il a été congelé dans des bouteilles individuelles par rotation dans un milieu réfrigérant. En utilisant ce processus, le sang pourrait être desséché de l’état congelé sous un vide poussé pendant de longues périodes de stockage. Les méthodes de base préférées par Greaves étaient presque identiques à celles de Mudd et Flosdorf. Une différence mineure dans les méthodes concernait le refroidissement du condenseur avec un bain d’alcool plutôt qu’avec de la neige carbonique, principalement à des fins de coût. Une autre différence résidait dans l’accent mis sur la congélation par centrifugation sous vide développée par Greaves et ses collègues, qui deviendraient la norme de l’industrie. Cette technique consiste à congeler le plasma en faisant tourner les bouteilles à grande vitesse dans une chambre de sous-congélation. Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre. Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre. Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre.
Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre. Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre. Cette action centrifuge répartit uniformément le plasma sur les parois internes du récipient jusqu’à ce qu’il soit congelé. Cela donne l’avantage d’une couche plus uniforme et les cristaux congelés sont plus finement divisés, ce qui permet une reconstitution plus rapide du produit séché. Cette méthode était plus largement utilisée au Canada et en Angleterre.
Le travail de ces trois hommes a développé des normes pour les méthodes de lyophilisation en 1945 qui sont devenues des éléments cruciaux des programmes de sang et de transfusion de la Seconde Guerre mondiale. Le processus suivi par le sang lors de son séchage et de son stockage est illustré à la figure 1, dans un laboratoire de service à Houston, au Texas.
La mise en œuvre de ces techniques pose des problèmes de typage sanguin et de rejet de certaines transfusions sanguines chez les militaires. Cela a ouvert la voie à de nouvelles études sur les composants du sang et sur la manière exacte dont le corps réagit lorsque des transfusions sont effectuées. Par conséquent, les hommes qui ont développé le processus de séchage du sang pour les transfusions ont inspiré d’autres personnes à étudier davantage ce domaine et à travailler pour comprendre complètement le processus de transfusion et découvrir tous les composants impliqués.
Le développement du séchage du sang a conduit à l’utilisation de ce procédé pour la conservation de nombreux autres produits biologiques, y compris les virus vivants à utiliser dans les vaccins, les bactéries vivantes, les hormones, les extraits de tissus, les antibiotiques, comme la pénicilline, et même les agents chimio thérapeutiques, ou anticancéreux médicaments thérapeutiques. Ces techniques sont même devenues courantes dans l’industrie alimentaire, en particulier pour le lait, les œufs, la viande, les légumes et les fruits.
Selon les National Institutes of Health, chaque année, près de 5 millions de personnes aux États-Unis reçoivent des transfusions sanguines vitales. Ces méthodes ont permis de sauver des millions de vies, non seulement en Pennsylvanie, ni même aux États-Unis, mais dans le monde entier. La pratique de la transfusion sanguine est devenue cruciale non seulement sur le champ de bataille mais aussi dans les chirurgies civiles et les transfusions pour les malades. La variété des applications pour lesquelles ce procédé a été utilisé est innombrable. Ces hommes ont inspiré d’autres scientifiques à repousser les limites et à ouvrir des portes dans l’étude du sang. Mudd et Flosdorf ont apporté des contributions au monde scientifique bien au-delà de la portée à laquelle ils auraient pu penser lorsqu’un jour, leur bricolage dans le laboratoire a conduit au séchage du sang humain.
À l’échelle mondiale, 296 millions de personnes sont infectées par le virus de l’hépatite B (VHB) et environ un million de personnes meurent chaque année de causes liées au VHB, y compris le cancer du foie. Bien qu’il existe un vaccin préventif et des thérapies antivirales supprimant la réplication du VHB, il n’y a pas de remède. Des efforts intensifs sont en cours pour développer des thérapies curatives contre le VHB. Actuellement, seuls quelques biomarqueurs sont disponibles pour surveiller ou prédire la progression de la maladie du VHB et la réponse au traitement. À mesure que de nouvelles thérapies deviennent disponibles, de nouveaux biomarqueurs pour surveiller les réponses virales et de l’hôte sont nécessaires de toute urgence. -carousel33f71ccb659564f3a772ff0000325351_15ac1587-cc95-4bc0-a19a-6be5b5768de6.jpg?sfvrsn=a9627869_2&w=519&h=591&mode=crop) En octobre 2020, la Coalition internationale pour l’élimination du virus de l’hépatite B (ICE-HBV) a organisé un atelier virtuel et interactif sur les biomarqueurs du VHB approuvé par la réunion internationale sur le VHB. Divers intervenants du milieu universitaire, de la pratique clinique et de l’industrie pharmaceutique, aux expertises complémentaires, ont présenté et participé à des tables rondes. L’utilité clinique des biomarqueurs sériques viraux et immunologiques classiques et émergents en ce qui concerne l’évolution de l’infection, la progression de la maladie et la réponse aux traitements actuels et émergents a été évaluée. Les dernières avancées ont été discutées et les lacunes dans les connaissances dans la compréhension et l’interprétation des biomarqueurs du VHB ont été identifiées. Cette feuille de route résume les forces, les faiblesses, les opportunités et les défis des biomarqueurs du VHB.
En octobre 2020, la Coalition internationale pour l’élimination du virus de l’hépatite B (ICE-HBV) a organisé un atelier virtuel et interactif sur les biomarqueurs du VHB approuvé par la réunion internationale sur le VHB. Divers intervenants du milieu universitaire, de la pratique clinique et de l’industrie pharmaceutique, aux expertises complémentaires, ont présenté et participé à des tables rondes. L’utilité clinique des biomarqueurs sériques viraux et immunologiques classiques et émergents en ce qui concerne l’évolution de l’infection, la progression de la maladie et la réponse aux traitements actuels et émergents a été évaluée. Les dernières avancées ont été discutées et les lacunes dans les connaissances dans la compréhension et l’interprétation des biomarqueurs du VHB ont été identifiées. Cette feuille de route résume les forces, les faiblesses, les opportunités et les défis des biomarqueurs du VHB. Sérum de sang séché
Sérum de sang séché
En 1933, du sérum sanguin humain séché a été préparé pour la première fois aux États-Unis à l’école de médecine de l’Université de Pennsylvanie, Philadelphie, Pennsylvanie. Il a été préparé par les Drs. Earl W. Flosdorf, un ingénieur frigoriste expérimenté, et Stuart Mudd qui a créé un appareil en verre pour lyophiliser le sérum, le liquide clair dans le sang qui contient les protéines et les anticorps formés par le système immunitaire du corps pour se protéger contre les infections. Le sérum sanguin séché en poudre a été utilisé avec succès pour les transfusions pour la prévention des maladies infantiles. La méthode a été décrite pour la première fois en avril de l’année suivante lors d’une réunion de l’American Chemical Society à Saint-Pétersbourg, en Floride. Du sérum sanguin séché a été utilisé pendant la Seconde Guerre mondiale.
https://www.degruyter.com/document/doi/10.1515/cclm-2013-0228/html