 Le plus connu pour ses contributions à la théorie moléculaire, y compris ce qu’on appelle la loi d’Avogadro
Le plus connu pour ses contributions à la théorie moléculaire, y compris ce qu’on appelle la loi d’Avogadro Amedeo Avogadro (9 août 1776 – 9 juillet 1856) était un scientifique italien connu pour ses recherches sur le volume, la pression et la température des gaz. Il a formulé la loi des gaz connue sous le nom de loi d’Avogadro, qui stipule que tous les gaz, à la même température et pression, ont le même nombre de molécules par volume. Aujourd’hui, Avogadro est considéré comme l’une des premières figures importantes de la théorie atomique.
Amedeo Avogadro (9 août 1776 – 9 juillet 1856) était un scientifique italien connu pour ses recherches sur le volume, la pression et la température des gaz. Il a formulé la loi des gaz connue sous le nom de loi d’Avogadro, qui stipule que tous les gaz, à la même température et pression, ont le même nombre de molécules par volume. Aujourd’hui, Avogadro est considéré comme l’une des premières figures importantes de la théorie atomique. Début de la vie
Début de la vie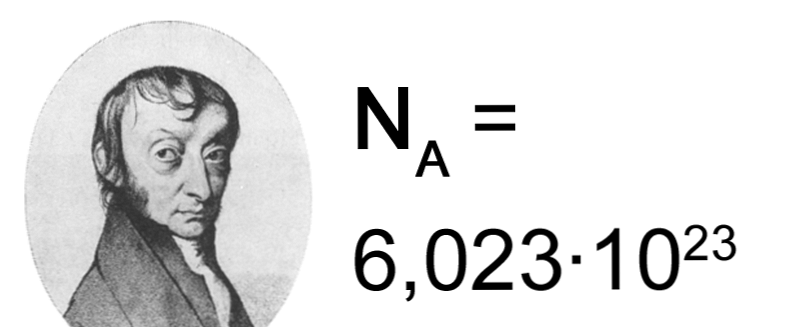 Lorenzo Romano Amedeo Carlo Avogadro est né dans une famille d’éminents avocats italiens en 1776. Suivant les traces de sa famille, il a étudié le droit ecclésiastique et a commencé à pratiquer seul avant de se tourner finalement vers les sciences naturelles. En 1800, Avogadro a commencé des études privées en physique et en mathématiques. Ses toutes premières expériences ont été menées avec son frère sur le thème de l’électricité.
Lorenzo Romano Amedeo Carlo Avogadro est né dans une famille d’éminents avocats italiens en 1776. Suivant les traces de sa famille, il a étudié le droit ecclésiastique et a commencé à pratiquer seul avant de se tourner finalement vers les sciences naturelles. En 1800, Avogadro a commencé des études privées en physique et en mathématiques. Ses toutes premières expériences ont été menées avec son frère sur le thème de l’électricité. Carrière
Carrière
 Avogadro n’était pas seul dans son étude des gaz et des molécules. Deux autres scientifiques – le chimiste anglais John Dalton et le chimiste français Joseph Gay-Lussac – exploraient également ces sujets à peu près à la même époque, et leurs travaux ont eu une forte influence sur lui. Dalton est surtout connu pour avoir énoncé les bases de la théorie atomique, à savoir que toute matière est composée de minuscules particules indivisibles appelées atomes. Gay-Lussac est surtout connu pour sa loi éponyme sur la pression et la température des gaz.
Avogadro n’était pas seul dans son étude des gaz et des molécules. Deux autres scientifiques – le chimiste anglais John Dalton et le chimiste français Joseph Gay-Lussac – exploraient également ces sujets à peu près à la même époque, et leurs travaux ont eu une forte influence sur lui. Dalton est surtout connu pour avoir énoncé les bases de la théorie atomique, à savoir que toute matière est composée de minuscules particules indivisibles appelées atomes. Gay-Lussac est surtout connu pour sa loi éponyme sur la pression et la température des gaz.
 En 1814, Avogadro publie un mémoire sur les densités de gaz et, en 1820, il devient la première chaire de physique mathématique à l’Université de Turin. En tant que membre d’une commission gouvernementale sur les poids et mesures, il a aidé à introduire le système métrique dans la région du Piémont en Italie. La normalisation des mesures a permis aux scientifiques de différentes régions de comprendre, de comparer et d’évaluer plus facilement le travail de chacun. Avogadro a également été membre du Conseil supérieur royal de l’instruction publique.
En 1814, Avogadro publie un mémoire sur les densités de gaz et, en 1820, il devient la première chaire de physique mathématique à l’Université de Turin. En tant que membre d’une commission gouvernementale sur les poids et mesures, il a aidé à introduire le système métrique dans la région du Piémont en Italie. La normalisation des mesures a permis aux scientifiques de différentes régions de comprendre, de comparer et d’évaluer plus facilement le travail de chacun. Avogadro a également été membre du Conseil supérieur royal de l’instruction publique. Vie privée
Vie privée
Décès
En 1850, Avogadro se retira de l’Université de Turin à l’âge de 74 ans. Il mourut le 9 juillet 1856. Héritage
Héritage Avogadro est surtout connu aujourd’hui pour sa loi des gaz éponyme, qui stipule que des volumes égaux de gaz, à la même température et pression, contiennent le même nombre de molécules. L’hypothèse d’Avogadro n’a été généralement acceptée qu’en 1858 (deux ans après la mort d’Avogadro) lorsque le chimiste italien Stanislao Cannizzaro a pu expliquer pourquoi il y avait des exceptions chimiques organiques à l’hypothèse d’Avogadro. Cannizzaro a aidé à clarifier certaines des idées d’Avogadro, y compris sa vision de la relation entre les atomes et les molécules. Il a également fourni des preuves empiriques en calculant les poids moléculaires (atomiques) de diverses substances.
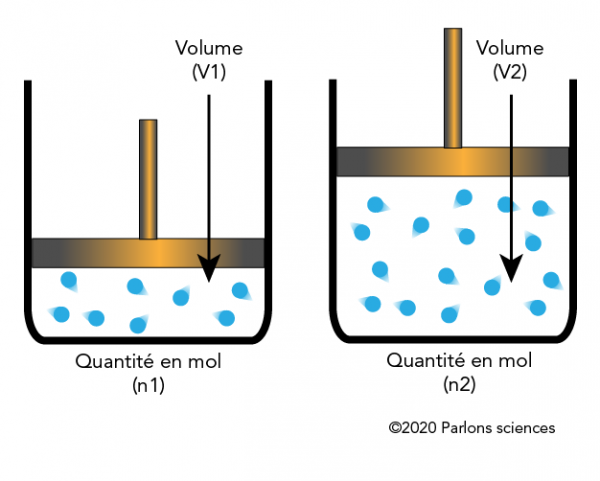
Avogadro est surtout connu aujourd’hui pour sa loi des gaz éponyme, qui stipule que des volumes égaux de gaz, à la même température et pression, contiennent le même nombre de molécules. L’hypothèse d’Avogadro n’a été généralement acceptée qu’en 1858 (deux ans après la mort d’Avogadro) lorsque le chimiste italien Stanislao Cannizzaro a pu expliquer pourquoi il y avait des exceptions chimiques organiques à l’hypothèse d’Avogadro. Cannizzaro a aidé à clarifier certaines des idées d’Avogadro, y compris sa vision de la relation entre les atomes et les molécules. Il a également fourni des preuves empiriques en calculant les poids moléculaires (atomiques) de diverses substances. L’une des contributions les plus importantes du travail d’Avogadro a été sa résolution de la confusion entourant les atomes et les molécules (bien qu’il n’ait pas utilisé le terme « atome »). Avogadro croyait que les particules pouvaient être composées de molécules et que les molécules pouvaient être composées d’unités encore plus simples (que nous appelons maintenant « atomes »). Le nombre de molécules dans une taupe (poids moléculaire d’un gramme) a été appelé nombre d’Avogadro (parfois appelé constante d’Avogadro) en l’honneur des théories d’Avogadro. Le nombre d’Avogadro a été expérimentalement déterminé à 6,023×10 23 molécules par gramme-mole.
L’une des contributions les plus importantes du travail d’Avogadro a été sa résolution de la confusion entourant les atomes et les molécules (bien qu’il n’ait pas utilisé le terme « atome »). Avogadro croyait que les particules pouvaient être composées de molécules et que les molécules pouvaient être composées d’unités encore plus simples (que nous appelons maintenant « atomes »). Le nombre de molécules dans une taupe (poids moléculaire d’un gramme) a été appelé nombre d’Avogadro (parfois appelé constante d’Avogadro) en l’honneur des théories d’Avogadro. Le nombre d’Avogadro a été expérimentalement déterminé à 6,023×10 23 molécules par gramme-mole. Chimiste et physicien italien qui a découvert qu’à la même température et à la même pression, des volumes égaux de tous les gaz parfaits contiennent le même nombre de particules, connu sous le nom de loi d’Avogadro (1811) conduisant à la constante d’Avogadro qui est de 6,022 x 10**23 unités par mole d’une substance. Il s’est rendu compte que les particules pouvaient être soit des atomes, soit, plus souvent, des combinaisons d’atomes, pour lesquelles il a inventé le mot « molécule ». Cela explique la loi de Gay-Lussac sur la combinaison des volumes (1809). En outre, Avogadro a déterminé, à partir de l’électrolyse de l’eau, que celle-ci contenait des molécules formées de deux atomes d’hydrogène pour chaque atome d’oxygène, ce qui signifie que l’atome d’oxygène individuel était 16 fois plus lourd qu’un atome d’hydrogène (et non 8 fois comme l’avait suggéré John Dalton). »
Chimiste et physicien italien qui a découvert qu’à la même température et à la même pression, des volumes égaux de tous les gaz parfaits contiennent le même nombre de particules, connu sous le nom de loi d’Avogadro (1811) conduisant à la constante d’Avogadro qui est de 6,022 x 10**23 unités par mole d’une substance. Il s’est rendu compte que les particules pouvaient être soit des atomes, soit, plus souvent, des combinaisons d’atomes, pour lesquelles il a inventé le mot « molécule ». Cela explique la loi de Gay-Lussac sur la combinaison des volumes (1809). En outre, Avogadro a déterminé, à partir de l’électrolyse de l’eau, que celle-ci contenait des molécules formées de deux atomes d’hydrogène pour chaque atome d’oxygène, ce qui signifie que l’atome d’oxygène individuel était 16 fois plus lourd qu’un atome d’hydrogène (et non 8 fois comme l’avait suggéré John Dalton). »
En hommage à lui, le nombre d’entités élémentaires dans 1 mole d’une substance, 6,02214076×10^23 mol−1, est connu sous le nom de constante d’Avogadro.
Événements historiques
1811-07-11 Le scientifique italien Amedeo Avogadro publie ses mémoires sur le contenu moléculaire des gaz
En bref : Amedeo Avogadro
Connu pour : Formulation de la loi expérimentale des gaz connue sous le nom de loi d’Avogadro
Naissance : 9 août 1776 à Turin, Italie
Décédé : 9 juillet 1856 à Turin, Italie
Ouvrages publiés : Essai d’une manière de déterminer les masses relatives des molécules élémentaires des corps, et les proportions selon qu’elles entrent dans ces combinaisons. Ces combinaisons »)
Conjoint : Felicita Mazzé
https://www.thoughtco.com/amedeo-avogadro-biography-606872