 Généticien américain qui a contribué à cartographier le code génétique et à identifier la base génétique du cancer.
Généticien américain qui a contribué à cartographier le code génétique et à identifier la base génétique du cancer.:max_bytes(150000):strip_icc()/codon_table_1-efc5c05d1e89497899aed285f86274fd.jpg) Philip Leder, qui a aidé à déchiffrer le code génétique,
Philip Leder, qui a aidé à déchiffrer le code génétique, Philip Leder, un biologiste qui a aidé à déchiffrer le code génétique et découvert une cause génétique du cancer, est décédé le 2 février à son domicile de Chestnut Hill, Mass. Il avait 85 ans. La cause était des complications de la maladie de Parkinson, a déclaré son fils Benjamin Z. Leder. Le Dr Leder a aidé à accomplir la dernière étape du déchiffrement du code génétique au début de sa carrière. En immunologie, il a ensuite aidé à démêler les mécanismes génétiques derrière la grande diversité des molécules d’anticorps. Il a ensuite découvert que la mauvaise régulation d’un gène qui guide la croissance des cellules était une cause majeure de cancer.
Philip Leder, un biologiste qui a aidé à déchiffrer le code génétique et découvert une cause génétique du cancer, est décédé le 2 février à son domicile de Chestnut Hill, Mass. Il avait 85 ans. La cause était des complications de la maladie de Parkinson, a déclaré son fils Benjamin Z. Leder. Le Dr Leder a aidé à accomplir la dernière étape du déchiffrement du code génétique au début de sa carrière. En immunologie, il a ensuite aidé à démêler les mécanismes génétiques derrière la grande diversité des molécules d’anticorps. Il a ensuite découvert que la mauvaise régulation d’un gène qui guide la croissance des cellules était une cause majeure de cancer. Le Dr Leder était étudiant postdoctoral aux National Institutes of Health de Bethesda, dans le Maryland, en 1962 lorsque, neuf ans après la découverte de la structure de l’ADN, il a été recruté par Marshall Nirenberg. Les deux hommes sont entrés dans une course effrénée de biologistes du monde entier pour résoudre le code génétique, le moyen par lequel des unités successives d’ADN spécifient l’ordre des acides aminés, les éléments constitutifs des protéines. Au milieu de nombreuses spéculations théoriques sur la façon dont cela pourrait fonctionner, le Dr Nirenberg est tombé sur une approche pratique du problème : alimenter des brins synthétiques d’ARN – le système de messagerie de l’ADN – dans des cellules vivantes et voir quels acides aminés ont été invoqués dans la machinerie de fabrication des protéines.
Le Dr Leder était étudiant postdoctoral aux National Institutes of Health de Bethesda, dans le Maryland, en 1962 lorsque, neuf ans après la découverte de la structure de l’ADN, il a été recruté par Marshall Nirenberg. Les deux hommes sont entrés dans une course effrénée de biologistes du monde entier pour résoudre le code génétique, le moyen par lequel des unités successives d’ADN spécifient l’ordre des acides aminés, les éléments constitutifs des protéines. Au milieu de nombreuses spéculations théoriques sur la façon dont cela pourrait fonctionner, le Dr Nirenberg est tombé sur une approche pratique du problème : alimenter des brins synthétiques d’ARN – le système de messagerie de l’ADN – dans des cellules vivantes et voir quels acides aminés ont été invoqués dans la machinerie de fabrication des protéines.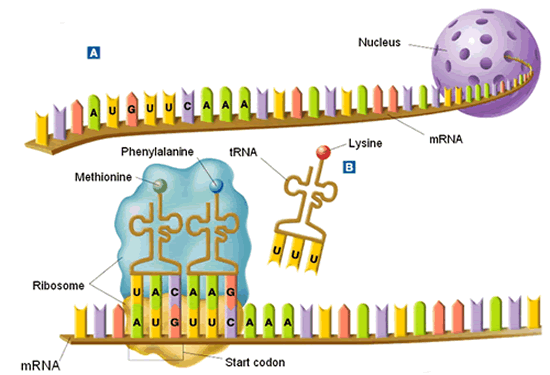 Le Dr Nirenberg avait découvert qu’une longue chaîne d’unités d’ARN désignées U, pour uracile, inciterait la cellule à fabriquer des protéines à partir de l’acide aminé phénylalanine. Il semblait donc que UUU — on pensait que le code se lisait en triplets — désignait la phénylalanine. Mais il était difficile d’exploiter cette découverte jusqu’à ce que le Dr Leder développe un moyen de synthétiser des triplets d’ARN d’une séquence spécifique. En testant un par un ces 64 arrangements de triplets, les deux chercheurs ont découvert quel triplet d’ARN spécifiait chacun des 20 acides aminés qu’une cellule utilise pour construire des molécules de protéines.
Le Dr Nirenberg avait découvert qu’une longue chaîne d’unités d’ARN désignées U, pour uracile, inciterait la cellule à fabriquer des protéines à partir de l’acide aminé phénylalanine. Il semblait donc que UUU — on pensait que le code se lisait en triplets — désignait la phénylalanine. Mais il était difficile d’exploiter cette découverte jusqu’à ce que le Dr Leder développe un moyen de synthétiser des triplets d’ARN d’une séquence spécifique. En testant un par un ces 64 arrangements de triplets, les deux chercheurs ont découvert quel triplet d’ARN spécifiait chacun des 20 acides aminés qu’une cellule utilise pour construire des molécules de protéines.
En 1966, ils avaient compris la majeure partie du code dans ce que le Dr Leder appelait « une course folle » avec d’autres laboratoires, notamment une équipe dirigée par le lauréat du prix Nobel Severo Ochoa. « Je n’ai pas pu dormir pendant des jours à cause de l’excitation », a déclaré le Dr Leder dans une interview en 2012 avec ASBMB Today, le magazine de la Société américaine de biochimie et de biologie moléculaire. « J’allais me coucher en pensant aux expériences du lendemain, puis je sautais du lit le matin et me précipitais au laboratoire », a-t-il déclaré.
La résolution du code génétique a valu un prix Nobel au Dr Nirenberg, son chef de laboratoire, en 1968. Le Dr Leder s’est ensuite tourné vers le problème de la structure des gènes et a élaboré la composition des unités d’ADN dans le gène de l’alpha-globine, le premier gène de mammifère à être séquencé. Quatre unités de globine, deux alpha et deux bêta, composent l’hémoglobine, le composant porteur d’oxygène des globules rouges. En 1980, il a quitté les National Institutes of Health pour Harvard et est devenu président fondateur du nouveau département de génétique de l’université, poste qu’il a occupé jusqu’en 2008. Explorant comment les gènes du système immunitaire produisent une grande diversité d’anticorps, les mécanismes de défense contre maladie infectieuse, il a découvert que les cellules réarrangent méthodiquement les deux gènes qui codent une partie de la molécule d’immunoglobuline.
Les cellules productrices d’anticorps, appelées cellules B, sont le site d’un cancer rare appelé lymphome de Burkitt. Le Dr Leder a découvert que dans les cellules du lymphome de Burkitt, les chromosomes sont réarrangés par erreur de telle sorte qu’un gène appelé myc, impliqué dans le contrôle de la croissance d’une cellule, est permuté dans une région contenant les gènes d’immunoglobuline. Divorcé de ses contrôles réglementaires appropriés, le gène myc entraîne la cellule B dans la prolifération cancéreuse. Le Dr Leder a ensuite montré que si un gène myc dépouillé de son système de régulation est injecté dans le génome de la souris, les souris de l’expérience seront exceptionnellement sujettes au cancer. Il a reçu le prestigieux prix Albert Lasker en 1987 pour ses travaux sur la génétique des immunoglobulines et du cancer.
Philip Leder est né le 19 novembre 1934 à Washington. Sa mère, Jacqueline Bourke, était infirmière jusqu’à ce qu’elle épouse son père, George Jacob Leder, qui possédait des magasins de vêtements pour enfants à Arlington et Falls Church, en Virginie. Philip a fréquenté le Western High School à Washington, puis est allé à Harvard, où il a obtenu un baccalauréat en 1956 et un diplôme de médecine quatre ans plus tard. Il laisse dans le deuil son épouse depuis 60 ans, Aya (Brudner) Leder ; trois enfants, Micki, Ethan et Benjamin Leder ; et huit petits-enfants. Dans une interview sur le site Web de la Fondation Lasker, le Dr Leder a noté que la recherche scientifique n’était pas pour les timides. « Si vous ne supportez pas l’échec et la déception, vous ne pouvez pas faire ce travail », a-t-il déclaré. « Ce pour quoi vous travaillez dans cette entreprise, c’est l’appréciation réticente des quelques collègues qui comprennent ce que vous faites. »
Il a souvent dit qu’il avait eu ses meilleures idées scientifiques en écoutant de la musique classique, à tel point qu’il emportait un bloc-notes avec lui lors de concerts. Le Dr Leder a donné une interview pour un livre de 1994 « Le Dieu auquel je crois : Conversations sur le judaïsme ». L’auteur, Joshua O. Haberman, lui a demandé s’il croyait en l’espoir d’un Messie. Le Dr Leder a répondu : « J’ai la conviction que, à mesure que nous nous comprendrons davantage en tant qu’êtres, en tant qu’individus, en tant qu’organismes génétiquement programmés, cette connaissance contribuera à améliorer la condition humaine. C’est un peu difficile d’assimiler cela à une foi messianique, mais c’est ma foi messianique en quelque sorte.
Réalisations scientifiques  Leder a apporté plusieurs contributions au cours de chaque décennie de l’ère de la génétique moderne des années 1960 aux années 1990. Il est peut-être mieux connu pour ses premiers travaux avec Marshall Nirenberg dans l’élucidation du code génétique et l’expérience Nirenberg et Leder. Depuis, il a apporté plusieurs contributions dans les domaines de la génétique moléculaire, de l’immunologie et de la génétique du cancer. Son groupe a défini la séquence de bases d’un gène complet de mammifère (le gène de la bêta-globine), ce qui lui a permis de déterminer en détail son organisation, y compris ses signaux de commande associés. Ses recherches sur la structure des gènes qui portent le code des molécules d’anticorps étaient d’une importance majeure.
Leder a apporté plusieurs contributions au cours de chaque décennie de l’ère de la génétique moderne des années 1960 aux années 1990. Il est peut-être mieux connu pour ses premiers travaux avec Marshall Nirenberg dans l’élucidation du code génétique et l’expérience Nirenberg et Leder. Depuis, il a apporté plusieurs contributions dans les domaines de la génétique moléculaire, de l’immunologie et de la génétique du cancer. Son groupe a défini la séquence de bases d’un gène complet de mammifère (le gène de la bêta-globine), ce qui lui a permis de déterminer en détail son organisation, y compris ses signaux de commande associés. Ses recherches sur la structure des gènes qui portent le code des molécules d’anticorps étaient d’une importance majeure.  L’objectif principal de cette enquête était la question de savoir comment la grande diversité des molécules d’anticorps est formée par un nombre limité de gènes codés. Les travaux de Leder sur les gènes d’anticorps ont ensuite été étendus à la recherche sur le lymphome de Burkitt, une tumeur de cellules productrices d’anticorps, qui implique l’oncogène c-myc. C’était crucial pour comprendre l’origine de ce type de tumeur. En 1988, Leder et Timothy Stewart ont obtenu le premier brevet sur un animal génétiquement modifié. Cet animal, une souris à qui on a injecté des gènes dans son embryon pour augmenter sa susceptibilité au cancer, est devenue connu sous le nom d’« oncosouris » et a été utilisé dans l’étude en laboratoire des thérapies anticancéreuses.
L’objectif principal de cette enquête était la question de savoir comment la grande diversité des molécules d’anticorps est formée par un nombre limité de gènes codés. Les travaux de Leder sur les gènes d’anticorps ont ensuite été étendus à la recherche sur le lymphome de Burkitt, une tumeur de cellules productrices d’anticorps, qui implique l’oncogène c-myc. C’était crucial pour comprendre l’origine de ce type de tumeur. En 1988, Leder et Timothy Stewart ont obtenu le premier brevet sur un animal génétiquement modifié. Cet animal, une souris à qui on a injecté des gènes dans son embryon pour augmenter sa susceptibilité au cancer, est devenue connu sous le nom d’« oncosouris » et a été utilisé dans l’étude en laboratoire des thérapies anticancéreuses.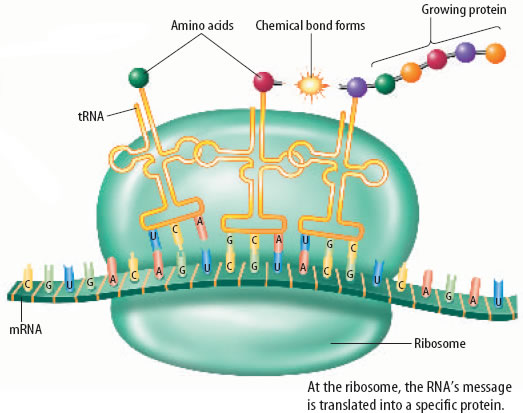 Postes
Postes
En 1968, Leder a dirigé le département de biochimie du programme d’études supérieures de la Fondation pour l’enseignement supérieur en sciences à l’Institut national de la santé. En 1972, il a été nommé directeur du Laboratoire de génétique moléculaire de la même institution et est resté à ce poste jusqu’en 1980, date à laquelle il est retourné à la Harvard Medical School en tant que fondateur du nouveau département de génétique, occupant la chaire John Emory Andrus. Il a pris sa retraite de ce poste en 2008 et est décédé des complications de la maladie de Parkinson le 2 février 2020.
Récompenses
Leder a reçu diverses distinctions et a été membre de l’Académie nationale des sciences, de l’Académie américaine des arts et des sciences et de l’Institute of Medicine. Ses nombreux prix incluent le Golden Plate Award de l’American Academy of Achievement (1981), [3] le Lasker Award (1987), la National Medal of Science (1991), le Harvey Prize et le Heineken Prize décerné par la Royal Netherlands Académie des Arts et des Sciences. En novembre 2015, il a reçu un doctorat honorifique de la Faculté de médecine de l’Université de Bâle pour l’ensemble de ses réalisations.
Souvenirs : Phil Leder (1934-2020)
La carrière scientifique remarquable de Phil au NIH et plus tard à Harvard a entraîné des percées dans le génie génétique, l’immunologie et la recherche sur le cancer. Les faits saillants de sa carrière comprenaient le développement du premier système de vecteur d’ADN recombinant pour répondre aux normes de sécurité spécifiées, qu’il a utilisé pour cloner le gène de la globine (le premier gène de mammifère cloné), et une série d’expériences créatives impliquant le gène c-myc et le lymphome de Burkitt qui a prouvé que la dérégulation d’un gène normal peut causer le cancer. Phil a été reconnu pour ses réalisations avec le prix Lasker (1987), la médaille nationale des sciences (1989), le prix israélien Harvey (1983), le prix néerlandais Heineken (1990) et l’élection à la fois à l’Académie nationale des sciences et à l’Académie nationale de médecine. Ses recherches ont soutenu le prix Nobel de Marshall Nirenberg en 1968, et il a été une force directrice pour Tasuku Honjo, son post-doctorant au NIH au début des années 1970, qui remportera un prix Nobel 2018 pour le traitement du cancer.
Phil est arrivé pour la première fois au NIH dans les années 1950 en tant que stagiaire de premier cycle dans le laboratoire de Martha Vaughan au National Heart Institute (NHI), maintenant connu sous le nom de National Heart, Lung, and Blood Institute. (LNHBI). Après avoir obtenu son diplôme de médecine de la Harvard Medical School en 1960 et effectué une résidence aux hôpitaux de l’Université du Minnesota, il est retourné au NIH en 1962, cette fois en tant que boursier postdoctoral au US Public Health Service et travaillant dans le laboratoire de Marshall Nirenberg au NHI. Section de génétique biochimique. C’était un an après les expériences polyU de Marshall avec Heinrich Matthaei, et Phil s’est lancé dans la course au codage. Phil a Co-conçu un instrument de filtration Millipore, surnommé le multi-plateau, qui a testé 45 échantillons à la fois, une amélioration significative par rapport à la technique à plateau unique testant un échantillon à la fois. (C’était son premier brevet, avec Charles Byrne.) Phil et ses collègues ont radio marqué des acides aminés, les ont liés à des séquences d’ARN à trois nucléotides et les ont fait passer à travers le filtre, l’essence de l’expérience de Nirenberg et Leder. Le filtre a capturé les ribosomes et a permis à l’équipe de déchiffrer les séquences de codons nucléotidiques avant que les autres équipes ne «concourent» dans la course au code.
Philip Leder (1934-2020) 
Généticien américain qui a contribué à cartographier le code génétique et à identifier la base génétique du cancer. Il a présenté l’oncosouris qui a été génétiquement modifiée pour être un modèle pour l’étude du cancer. Pour créer cette souris transgénique, les gènes critiques du cancer connus sous le nom d’oncogènes ont été introduits par injection dans des œufs de souris. Le 12 avril 1988, Leder et Timothy Stewart ont obtenu un brevet américain sur les mammifères transgéniques non humains (n° 4 736 866) résultant de leurs travaux sur l’oncosouris. Il a reçu la National Medal of Science en 1991.
https://irp.nih.gov/blog/post/2020/02/remembrances-phil-leder-1934-2020
https://www.nytimes.com/2020/02/23/science/philip-leder-dead.html
https://todayinsci.com/Events/Patent/Oncomouse4736866.htm
