J’ai fait mes premières études à la Lincoln School of Teachers College de l’Université de Columbia à New York, une école considérée comme progressiste à l’époque et qui a suscité en moi un intérêt actif pour les arts créatifs, la musique et l’écriture. Là, j’ai eu mon premier cours de chimie qui s’est avéré extrêmement précieux et intéressant. J’ai quitté cette école vers l’âge de seize ans et je suis allé dans une excellente école préparatoire de la Nouvelle-Angleterre, à savoir la Phillips Exeter Academy, qui était à l’époque, bien que cela ait changé depuis, une expérience éducative beaucoup plus rigide et beaucoup plus exigeante que celle que j’avais avait à Lincoln.  C’est à Exeter que j’ai été initié aux normes de précision de l’écriture et du travail en général qui, je pense, m’ont été très utiles, et je crois que la combinaison d’une école progressiste et d’une école plus exigeante comme j’ai apprécié était une préparation idéale. D’Exeter, je suis allé à Harvard où j’ai eu une carrière très agréable, bien que pas très distinguée sur le plan académique, et j’ai obtenu mon diplôme universitaire en 1933 au plus fort de la dépression économique. Je m’étais spécialisé en chimie à l’université et j’ai décidé de continuer à Harvard en tant qu’étudiant diplômé dans cette matière. Cela s’est avéré être une expérience plutôt malheureuse car ma première année d’études supérieures n’a pas été brillante, c’est le moins qu’on puisse dire. J’étais presque sur le point d’abandonner une carrière scientifique lorsqu’on m’a suggéré que j’apprécierais peut-être beaucoup plus la biochimie que la pure chimie organique.
C’est à Exeter que j’ai été initié aux normes de précision de l’écriture et du travail en général qui, je pense, m’ont été très utiles, et je crois que la combinaison d’une école progressiste et d’une école plus exigeante comme j’ai apprécié était une préparation idéale. D’Exeter, je suis allé à Harvard où j’ai eu une carrière très agréable, bien que pas très distinguée sur le plan académique, et j’ai obtenu mon diplôme universitaire en 1933 au plus fort de la dépression économique. Je m’étais spécialisé en chimie à l’université et j’ai décidé de continuer à Harvard en tant qu’étudiant diplômé dans cette matière. Cela s’est avéré être une expérience plutôt malheureuse car ma première année d’études supérieures n’a pas été brillante, c’est le moins qu’on puisse dire. J’étais presque sur le point d’abandonner une carrière scientifique lorsqu’on m’a suggéré que j’apprécierais peut-être beaucoup plus la biochimie que la pure chimie organique. L’année suivante, j’ai été transféré au Département de biochimie, alors dirigé par le regretté Hans Clarke, au Collège des médecins et chirurgiens de l’Université Columbia à New York. Le département de Columbia a été une révélation pour moi. Le professeur Clarke avait réussi à s’entourer d’un corps professoral fascinant et actif et d’un groupe d’étudiants diplômés presque tout aussi stimulants. De ces deux, j’ai appris énormément de choses en peu de temps. Ma thèse portait sur l’analyse des acides aminés de la protéine élastine, dont on pensait alors qu’elle jouait un rôle dans les maladies coronariennes et j’ai terminé les exigences de mon diplôme à Columbia à la fin de 1937 et je suis allé directement au laboratoire de Max Bergmann à l’Institut Rockefeller.
L’année suivante, j’ai été transféré au Département de biochimie, alors dirigé par le regretté Hans Clarke, au Collège des médecins et chirurgiens de l’Université Columbia à New York. Le département de Columbia a été une révélation pour moi. Le professeur Clarke avait réussi à s’entourer d’un corps professoral fascinant et actif et d’un groupe d’étudiants diplômés presque tout aussi stimulants. De ces deux, j’ai appris énormément de choses en peu de temps. Ma thèse portait sur l’analyse des acides aminés de la protéine élastine, dont on pensait alors qu’elle jouait un rôle dans les maladies coronariennes et j’ai terminé les exigences de mon diplôme à Columbia à la fin de 1937 et je suis allé directement au laboratoire de Max Bergmann à l’Institut Rockefeller.
Alors que j’étais encore étudiant diplômé, j’ai eu l’extrême chance d’épouser, en 1936, Phoebe Hockstader qui m’a été d’un énorme soutien depuis. Nous avons trois fils, William H. Jr., 35 ans ; David F., 33 ans ; Robert J., 28 ans.
La tâche de Moore et moi-même était de concevoir des méthodes analytiques précises pour la détermination de la composition en acides aminés des protéines, parce que Bergmann croyait fermement, tout comme nous, que l’analyse des acides aminés des protéines avait la même relation avec ces macromolécules que l’analyse élémentaire avait. à la chimie des substances organiques plus simples. C’est au cours de cette période, au milieu des années trente, que Bergmann et Fruton et leurs collègues travaillaient sur la spécificité des enzymes protéolytiques, travaux qui ont eu un effet profond sur notre connaissance du fonctionnement des enzymes et ont rendu possible l’utilisation de ces enzymes protéolytiques comme outils pour la dégradation et la dérivation ultérieure de la structure des molécules de protéines depuis lors.
Les travaux sur les protéines ont été suspendus pendant la guerre pour d’autres questions plus urgentes et le Dr Moore a quitté le laboratoire afin d’aider à Washington et ailleurs. Tout notre groupe travaillait pour le Bureau de la recherche scientifique et du développement. La mort de Bergmann en 1944 a privé le monde d’un chimiste distingué et, bien sûr, a laissé le laboratoire sans chef. Le groupe a continué à fonctionner jusqu’à la fin de la guerre, date à laquelle Moore et moi avons eu la très grande chance d’être invités par le Dr Herbert Gasser, directeur de l’Institut, à rester à Rockefeller avec la liberté de faire tout ce que nous voulions dans le domaine biochimique.
Entre-temps, étaient venus les développements remarquables en Angleterre sur la séparation des acides aminés par chromatographie sur papier par Martin et Synge et Sanger avait commencé son travail classique sur la dérivation de la structure de l’insuline. Ce n’était alors peut-être pas surprenant que Moore et moi reprîmes notre collaboration, et suite à une suggestion de Synge commençâmes à essayer de séparer les acides aminés sur des colonnes de fécule de pomme de terre.  Nous avons eu la grande chance de trouver presque immédiatement un type de fécule de pomme de terre bien adapté à nos besoins et, à partir de ce jour, nous avons commencé à travailler d’abord sur l’analyse des acides aminés, puis sur l’analyse structurale des protéines. Des colonnes de fécule de pomme de terre, nous sommes passés aux colonnes de résines échangeuses d’ions, avons développé l’analyseur automatique d’acides aminés et, avec un groupe de collaborateurs très dévoués et extrêmement habiles, avons commencé à travailler sur la structure de la ribonucléase. Ces colonnes ont également été utilisées à d’autres fins. Au cours des premiers travaux, nous avons développé un collecteur de fractions automatique à comptage de gouttes qui est maintenant un instrument courant dans la plupart des laboratoires biochimiques à travers le monde.
Nous avons eu la grande chance de trouver presque immédiatement un type de fécule de pomme de terre bien adapté à nos besoins et, à partir de ce jour, nous avons commencé à travailler d’abord sur l’analyse des acides aminés, puis sur l’analyse structurale des protéines. Des colonnes de fécule de pomme de terre, nous sommes passés aux colonnes de résines échangeuses d’ions, avons développé l’analyseur automatique d’acides aminés et, avec un groupe de collaborateurs très dévoués et extrêmement habiles, avons commencé à travailler sur la structure de la ribonucléase. Ces colonnes ont également été utilisées à d’autres fins. Au cours des premiers travaux, nous avons développé un collecteur de fractions automatique à comptage de gouttes qui est maintenant un instrument courant dans la plupart des laboratoires biochimiques à travers le monde.
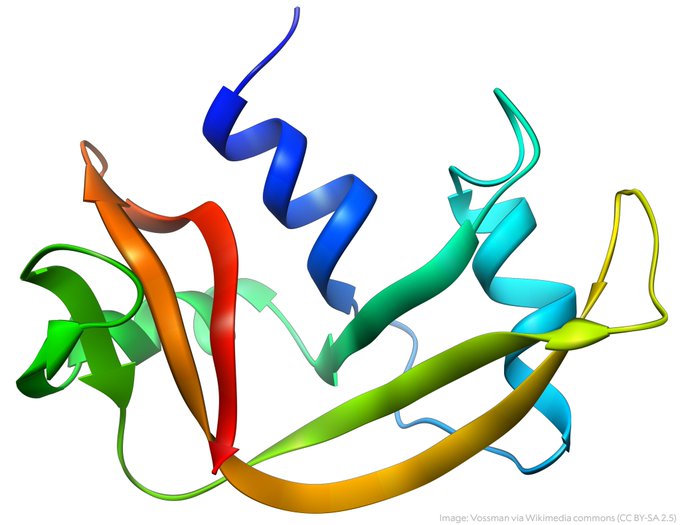
Je voudrais souligner que le développement des méthodes est né d’un besoin plutôt que d’un désir particulier de développer des méthodes comme une fin en soi. Nous avions besoin de connaître la composition en acides aminés des protéines, nous avions besoin de pouvoir séparer et analyser les peptides avec un bon rendement, et nous avions besoin de pouvoir purifier les protéines par chromatographie. Puisqu’il n’y avait aucune méthode pour faire l’une de ces choses au moment où nous avons commencé, nous avons dû les concevoir nous-mêmes. Nous voulions non seulement savoir quelle était la séquence d’acides aminés d’une enzyme telle que la ribonucléase, mais nous avons essayé d’en savoir autant que possible sur ce qui en faisait une enzyme et après avoir poussé cette enzyme particulière aussi loin que nous le pensions nous pouvions y aller avec profit, nous nous sommes tournés vers un certain nombre d’autres qui ont été répertoriés dans la conférence Nobel.
Pendant tout ce temps, nous avons eu le soutien indéfectible d’une administration éclairée chez Rockefeller qui croyait en nous permettant de faire les choses que nous pensions être importantes, et, au cours des dernières années de ce travail, nous avons également eu une grande aide financière du NIH. Pour cela et en particulier pour le très grand nombre de collègues dévoués et talentueux que nous avons eu au laboratoire, nous vous en serons éternellement reconnaissants.
Pendant tout ce temps, chacun de nous a naturellement développé des intérêts en dehors du laboratoire. Moi, par exemple, je suis devenu très préoccupé par la diffusion d’informations scientifiques et j’ai été attaché, d’une manière ou d’une autre, au Journal of Biological Chemistry pendant plus de quinze ans. Au cours de cette période, j’ai eu le privilège de travailler avec un groupe de biochimistes compétents et dévoués qui se sont consacrés de manière désintéressée à servir les intérêts de leurs collègues biochimistes à travers le monde.
Sociétés scientifiques – National Academy of Sciences
American Academy of Arts and Sciences, American Society of Biological Chemists, Biochemical Society of London, American Chemical Society, American Association for the Advancement of Science, Harvey Society of New York. J’ai été membre du comité de rédaction du Journal of Biological Chemistry, qui est un bureau électif, pendant six ans et président de ce comité pendant trois ans, de 1958 à 1961. Après la conclusion de mon travail au sein du comité de rédaction, je suis devenu membre du comité de rédaction du Journal of Biological Chemistry en 1962, puis rédacteur en chef adjoint de 1964 à 1968. J’ai assumé la rédaction, succédant à John T. Edsall, en 1968, poste que j’ai été contraint d’abandonner par maladie en 1971.
Autres activités – Membre du Conseil de l’Institut des maladies neurologiques et de la cécité du NIH, 1961-66 ; Président du Comité national américain de biochimie, 1968-69 ; Philip Schaffer Chargé de cours à l’Université de Washington à St. Louis, 1965; Conférencier Harvey, 1956; conférencier Phillips au Haverford College, 1962; Professeur invité à l’Université de Chicago, 1961 ; professeur invité à l’Université de Harvard, 1964 ; membre du conseil médical consultatif, université hébraïque-école de médecine Hadassah, 1957-1970 ; Syndic, Hôpital Montefiore. Récompenses (partagées avec Stanford Moore) : American Chemical Society Award en chromatographie et électrophorèse, 1964 ; Médaille Richards de l’American Chemical Society, 1972 ; Prix Kaj Linderstrøm-Lang, Copenhague, 1972.
Biochimiste américain qui a remporté le prix Nobel de chimie en 1972
Carrière
Après avoir terminé son doctorat, il a été intronisé au «Rockefeller Institute for Medical Research» en tant que chercheur en 1938 sous la direction du célèbre biochimiste juif-allemand Max Bergmann. Ici, il a eu l’occasion d’être associé à un groupe de chercheurs exceptionnels, dont Moore, Klaus Hofmann, Emil L. Smith et Joseph S. Fruton, entre autres. C’est au Rockefeller qu’il a mené la plupart de ses importants travaux de recherche.
Lui et Moore ont été délégués pour définir des procédures analytiques précises pour analyser la composition en acides aminés des protéines. Cependant, la «Seconde Guerre mondiale» a interrompu leurs travaux sur les protéines lorsque Moore a été enrôlé comme aide technique au «National Defense Research Council» à Washington en 1942. De plus, en temps de guerre, l’ensemble du groupe de recherche de Bergmann a été absorbé par le «Office de la recherche scientifique et du développement ».
Après la mort de Bergmann en 1944, le laboratoire est devenu sans chef, même si l’équipe de recherche a poursuivi ses travaux.
Après la guerre, Moore est retourné à l’Institut Rockefeller après avoir accepté une offre du directeur de l’époque, Herbert Gasser, qui a fourni à Stein et Moore la liberté et l’espace de mener des travaux de recherche dans leur domaine d’intérêt.
En 1952, il devient professeur de biochimie au « Rockefeller Institute for Medical Research » et occupe ce poste jusqu’en 1965. À ce moment-là, Archer John Porter Martin et Richard Laurence Millington Synge ont proposé un développement significatif de la séparation des acides aminés en appliquant la chromatographie sur papier en Angleterre.
À ce moment-là, Archer John Porter Martin et Richard Laurence Millington Synge ont proposé un développement significatif de la séparation des acides aminés en appliquant la chromatographie sur papier en Angleterre.
Suite à la suggestion de Synge, Stein et Moore se sont efforcés de séparer les acides aminés sur des colonnes de fécule de pomme de terre, marquant le début de leurs travaux sur les acides aminés. Le duo a réussi à séparer les acides aminés individuels d’un mélange synthétique, un travail qui a été présenté dans la revue scientifique à comité de lecture « Journal of Biological Chemistry ». Ils ont appliqué leurs procédures pour analyser les structures de l’albumine sérique bovine et de la β-lactoglobuline.
Le duo a réussi à séparer les acides aminés individuels d’un mélange synthétique, un travail qui a été présenté dans la revue scientifique à comité de lecture « Journal of Biological Chemistry ». Ils ont appliqué leurs procédures pour analyser les structures de l’albumine sérique bovine et de la β-lactoglobuline.
Pendant plus de quinze ans, il a été associé au ‘Journal of Biological Chemistry’ d’abord en tant que membre du comité de rédaction de 1955 à 1962. De 1958 à 1961, il est resté président du comité, après quoi il est devenu membre du comité de rédaction du journal en 1962. Par la suite, il a été rédacteur en chef adjoint de 1964 à 1968 et est finalement devenu rédacteur en chef du journal en 1968. Il a dû abandonner son poste en 1971 pour cause de maladie. De 1957 à 1970, il est resté membre du Conseil consultatif médical de «l’Université hébraïque-Hadassah Medical School».
De 1957 à 1970, il est resté membre du Conseil consultatif médical de «l’Université hébraïque-Hadassah Medical School».
En 1958, il a développé avec Moore le premier analyseur automatique d’acides aminés qui a facilité l’analyse des séquences d’acides aminés des protéines et ce développement a également conduit à déterminer la composition de l’enzyme ribonucléase.
En 1959, il a déclaré avec Moore la première analyse de la séquence entière d’acides aminés de la ribonucléase. Ils se sont également penchés sur l’examen de la composition, de la fonction et de l’association de plusieurs autres protéines telles que la ribonucléase pancréatique, la ribonucléase T1, la pepsine, la chymotrypsine, la désoxyribonucléase pancréatique et la protéinase streptococcique.
Ils ont été aidés financièrement pendant une période par le centre de recherche biomédicale, «National Institutes of Health» (NIH) dans leurs travaux de recherche. Il a été membre du Conseil de l’Institut des maladies neurologiques et de la cécité des « National Institutes of Health » de 1961 à 1966.
Il a été membre du Conseil de l’Institut des maladies neurologiques et de la cécité des « National Institutes of Health » de 1961 à 1966.
De 1965 à 1982, il est resté professeur de biochimie à la « Rockefeller University ».
Ses autres efforts académiques comprenaient le poste de professeur invité de «l’Université de Chicago» (1961), «Haverford College» (1962), «Harvard University» (1964) et «Washington University at St. Louis» (1965).
De 1968 à 1969, il a été président du Comité national américain de biochimie.
Il a été associé à plusieurs sociétés scientifiques dont ‘American Society of Biological Chemists’, ‘American Academy of Arts and Sciences’, ‘American Society for Biochemistry and Molecular Biology’, ‘American Association for the Advancement of Science’, ‘National Academy of Sciences ‘, ‘Harvey Society’ de New York, ‘Sigma Xi Scientific Research Society’ et ‘Biochemical Society’ de Londres. Stein est resté administrateur de «l’hôpital Montefiore». Il souffrait du syndrome de Guillain-Barré, une maladie rare dans laquelle le système immunitaire du corps attaque par erreur les nerfs périphériques et endommage leur isolation de myéline. Cette condition a entraîné sa paralysie vers 1971, limitant ainsi sa carrière de chercheur scientifique par la suite. Sa victoire au prix Nobel de chimie en 1972 a fait de lui le premier lauréat du prix Nobel tétraplégique.
Il souffrait du syndrome de Guillain-Barré, une maladie rare dans laquelle le système immunitaire du corps attaque par erreur les nerfs périphériques et endommage leur isolation de myéline. Cette condition a entraîné sa paralysie vers 1971, limitant ainsi sa carrière de chercheur scientifique par la suite. Sa victoire au prix Nobel de chimie en 1972 a fait de lui le premier lauréat du prix Nobel tétraplégique.
Le trouble physique l’a rendu en fauteuil roulant et la dernière étape de sa vie l’a vu se rendre occasionnellement au bureau jusqu’en 1980.
Le scientifique américain William H. Stein est surtout connu pour ses études sur l’enzyme ribonucléase (RNase) et pour ses travaux montrant comment des protéines composées des mêmes acides aminés peuvent avoir des caractéristiques et des fonctions très différentes. En 1958, Stein et son collègue et collaborateur fréquent Stanford Moore ont développé les premiers moyens d’analyse automatisée des acides aminés et, en 1963, ils sont devenus les premiers scientifiques à établir la structure et la séquence d’une enzyme. Stein a été atteint du syndrome de Guillain-Barr�, une maladie auto-immune des nerfs périphériques, qui l’a laissé paralysé après environ 1971.  Il est devenu le premier lauréat du prix Nobel tétraplégique lorsqu’il a remporté le prix Nobel de chimie en 1972, partageant l’honneur avec Moore. et avec Christian Anfinsen, un autre scientifique qui avait mené des études connexes sur la RNase à Harvard. Le travail scientifique de Stein a bien sûr été limité au cours de la dernière décennie de sa vie, mais il a organisé plusieurs séminaires informels sur des sujets scientifiques dans sa maison et a parfois visité son bureau dans son fauteuil roulant jusqu’à sa mort en 1980. Sa nécrologie pour l’Académie nationale des Sciences a été écrite par son ami Moore.
Il est devenu le premier lauréat du prix Nobel tétraplégique lorsqu’il a remporté le prix Nobel de chimie en 1972, partageant l’honneur avec Moore. et avec Christian Anfinsen, un autre scientifique qui avait mené des études connexes sur la RNase à Harvard. Le travail scientifique de Stein a bien sûr été limité au cours de la dernière décennie de sa vie, mais il a organisé plusieurs séminaires informels sur des sujets scientifiques dans sa maison et a parfois visité son bureau dans son fauteuil roulant jusqu’à sa mort en 1980. Sa nécrologie pour l’Académie nationale des Sciences a été écrite par son ami Moore.
William H. Stein (1911-1980) William Howard Stein était un biochimiste américain qui (avec Stanford Moore et Christian B. Anfinsen) a été co-lauréat du prix Nobel de chimie en 1972 pour leurs études sur l’enzyme pancréatique ribonucléase. Stein, avec Moore, a étudié le lien entre sa structure chimique et l’activité catalytique du centre actif de la molécule de ribonucléase. Entre 1949 et 1963, ils mettent au point des méthodes d’analyse des acides aminés et des peptides obtenus à partir de protéines, déterminent la structure de la ribonucléase et celle-ci catalyse la digestion des aliments. En 1972, ils avaient également élaboré la séquence complète de la désoxyribonucléase, une molécule deux fois plus complexe que la ribonucléase.
William Howard Stein était un biochimiste américain qui (avec Stanford Moore et Christian B. Anfinsen) a été co-lauréat du prix Nobel de chimie en 1972 pour leurs études sur l’enzyme pancréatique ribonucléase. Stein, avec Moore, a étudié le lien entre sa structure chimique et l’activité catalytique du centre actif de la molécule de ribonucléase. Entre 1949 et 1963, ils mettent au point des méthodes d’analyse des acides aminés et des peptides obtenus à partir de protéines, déterminent la structure de la ribonucléase et celle-ci catalyse la digestion des aliments. En 1972, ils avaient également élaboré la séquence complète de la désoxyribonucléase, une molécule deux fois plus complexe que la ribonucléase.
https://www.nobelprize.org/prizes/chemistry/1972/stein/biographical/
https://www.thefamouspeople.com/profiles/william-howard-stein-7518.php