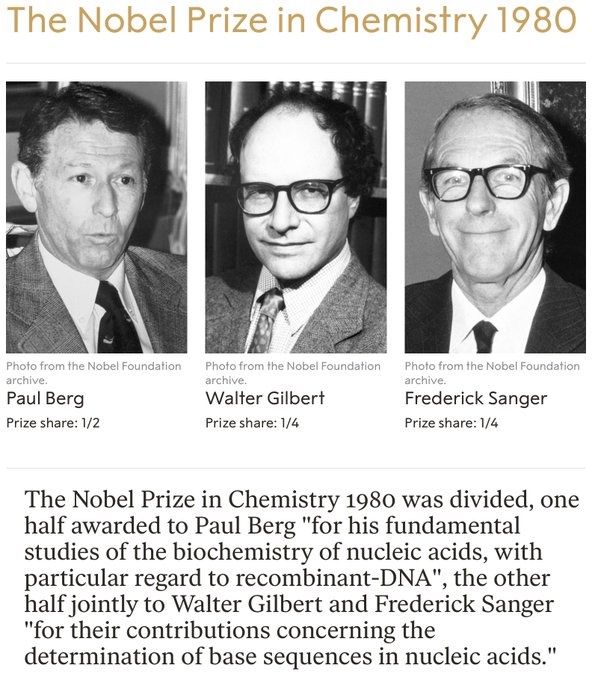

 Frederick Sanger (1918-2013) est né le 13 août 1918 à Rendcombe dans le Gloucestershire, deuxième fils de Frederick Sanger, médecin, et de sa femme Cicely. Il a fait ses études à la Bryanston School et au St. John’s College de Cambridge, où il a obtenu son baccalauréat en sciences naturelles en 1939. Depuis 1940, il a mené des recherches au Département de biochimie de Cambridge. De 1940 à 1943, il a travaillé avec le Dr A. Neuberger sur le métabolisme de l’acide aminé lysine et a obtenu un diplôme doctorat en 1943. De 1944 à 1951, il a été titulaire d’une bourse Beit Memorial pour la recherche médicale et depuis 1951, il est membre du personnel externe du Conseil de la recherche médicale.
Frederick Sanger (1918-2013) est né le 13 août 1918 à Rendcombe dans le Gloucestershire, deuxième fils de Frederick Sanger, médecin, et de sa femme Cicely. Il a fait ses études à la Bryanston School et au St. John’s College de Cambridge, où il a obtenu son baccalauréat en sciences naturelles en 1939. Depuis 1940, il a mené des recherches au Département de biochimie de Cambridge. De 1940 à 1943, il a travaillé avec le Dr A. Neuberger sur le métabolisme de l’acide aminé lysine et a obtenu un diplôme doctorat en 1943. De 1944 à 1951, il a été titulaire d’une bourse Beit Memorial pour la recherche médicale et depuis 1951, il est membre du personnel externe du Conseil de la recherche médicale.  Il occupe actuellement le poste de chef de la division de chimie des protéines au laboratoire MRC de biologie moléculaire à Cambridge. Depuis 1943, ses travaux portent principalement sur les problèmes liés à la détermination de la structure des protéines. Ces études ont abouti à la détermination de la structure de l’insuline. Sanger a reçu la médaille Corday-Morgan et le prix de la Chemical Society en 1951. En 1954, il est devenu membre de la Royal Society et membre du King’s College de Cambridge. Il est membre étranger honoraire de l’Académie américaine des arts et des sciences ; Membre honoraire de l’American Society of Biological Chemists, membre des Académies des sciences d’Argentine et du Brésil, membre honoraire de la Société japonaise de biochimie et membre correspondant de l’Association Qulmica Argentina.
Il occupe actuellement le poste de chef de la division de chimie des protéines au laboratoire MRC de biologie moléculaire à Cambridge. Depuis 1943, ses travaux portent principalement sur les problèmes liés à la détermination de la structure des protéines. Ces études ont abouti à la détermination de la structure de l’insuline. Sanger a reçu la médaille Corday-Morgan et le prix de la Chemical Society en 1951. En 1954, il est devenu membre de la Royal Society et membre du King’s College de Cambridge. Il est membre étranger honoraire de l’Académie américaine des arts et des sciences ; Membre honoraire de l’American Society of Biological Chemists, membre des Académies des sciences d’Argentine et du Brésil, membre honoraire de la Société japonaise de biochimie et membre correspondant de l’Association Qulmica Argentina. En 1940, il épousa Margaret Joan Howe ; ils ont deux fils et une fille.
En 1940, il épousa Margaret Joan Howe ; ils ont deux fils et une fille.
Addendum, mai 2005  Suite aux travaux sur l’insuline, il a développé d’autres méthodes pour étudier les protéines et en particulier les centres actifs de certaines enzymes. Vers 1960, il tourna son attention vers les acides nucléiques, l’ARN et l’ADN. Il a développé des méthodes pour déterminer de petites séquences dans l’ARN. Les travaux ont abouti à la mise au point de la technique «didésoxy» de séquençage de l’ADN vers 1975. Cette méthode relativement rapide a été utilisée pour déterminer la séquence d’ADN du bactériophage fx 174 de 5375 nucléotides en 1977, de l’ADN mitochondrial humain (16 338 nucléotides) et du bactériophage l (48 500 nucléotides). La méthode a été améliorée et automatisée dans d’autres génomes humains (3 milliards de nucléotides).
Suite aux travaux sur l’insuline, il a développé d’autres méthodes pour étudier les protéines et en particulier les centres actifs de certaines enzymes. Vers 1960, il tourna son attention vers les acides nucléiques, l’ARN et l’ADN. Il a développé des méthodes pour déterminer de petites séquences dans l’ARN. Les travaux ont abouti à la mise au point de la technique «didésoxy» de séquençage de l’ADN vers 1975. Cette méthode relativement rapide a été utilisée pour déterminer la séquence d’ADN du bactériophage fx 174 de 5375 nucléotides en 1977, de l’ADN mitochondrial humain (16 338 nucléotides) et du bactériophage l (48 500 nucléotides). La méthode a été améliorée et automatisée dans d’autres génomes humains (3 milliards de nucléotides). Frederick Sanger (1918–2013), pionnier de la génomique doublement lauréat du prix Nobel.
Frederick Sanger (1918–2013), pionnier de la génomique doublement lauréat du prix Nobel. Frederick Sanger, « le père de la génomique », était l’un des quatre scientifiques à avoir remporté deux prix Nobel et le seul à avoir reçu les deux en chimie. Tous deux ont été récompensés pour l’invention de méthodes permettant de déterminer l’ordre des éléments constitutifs biologiques de la vie.
Frederick Sanger, « le père de la génomique », était l’un des quatre scientifiques à avoir remporté deux prix Nobel et le seul à avoir reçu les deux en chimie. Tous deux ont été récompensés pour l’invention de méthodes permettant de déterminer l’ordre des éléments constitutifs biologiques de la vie.
On se souviendra surtout de Sanger pour avoir développé des techniques pour lire les As, Cs, Gs et Ts dans un brin d’ADN. Ce travail a fourni les moyens de déchiffrer le matériel génétique et a conduit à son deuxième prix, qu’il a partagé avec Paul Berg et Walter Gilbert en 1980. Dans les années 1990, la méthode éponyme de Sanger a été utilisée par des laboratoires du monde entier pour élaborer la séquence de génome humain. Son premier prix est venu en 1958 pour sa découverte de la façon dont les acides aminés sont reliés entre eux dans la protéine insuline. Dans les années 1950, beaucoup pensaient que les acides aminés d’une protéine étaient disposés de manière aléatoire, mais Sanger a prouvé sans aucun doute qu’ils formaient plutôt une séquence unique. Bien qu’il ait fait la lumière sur cette conclusion, affirmant que ceux qui connaissaient les protéines s’attendaient à ce résultat, le fait de savoir que les protéines avaient une séquence précise suggérait que cette information devait être codifiée dans l’ADN. Sanger, décédé à Cambridge, au Royaume-Uni, le 19 novembre à l’âge de 95 ans, est né en 1918 dans le Gloucestershire. Élevé comme quaker, il a appris l’autonomie et les compétences manuelles pratiques en tant qu’écolier. Ces aptitudes ont été utilisées à bon escient dans son laboratoire et dans la construction de voiliers.
Son premier prix est venu en 1958 pour sa découverte de la façon dont les acides aminés sont reliés entre eux dans la protéine insuline. Dans les années 1950, beaucoup pensaient que les acides aminés d’une protéine étaient disposés de manière aléatoire, mais Sanger a prouvé sans aucun doute qu’ils formaient plutôt une séquence unique. Bien qu’il ait fait la lumière sur cette conclusion, affirmant que ceux qui connaissaient les protéines s’attendaient à ce résultat, le fait de savoir que les protéines avaient une séquence précise suggérait que cette information devait être codifiée dans l’ADN. Sanger, décédé à Cambridge, au Royaume-Uni, le 19 novembre à l’âge de 95 ans, est né en 1918 dans le Gloucestershire. Élevé comme quaker, il a appris l’autonomie et les compétences manuelles pratiques en tant qu’écolier. Ces aptitudes ont été utilisées à bon escient dans son laboratoire et dans la construction de voiliers. Il a développé un intérêt pour la science grâce à son père médecin et à son frère aîné, avec qui il aimait le plein air. En 1939, il est diplômé en biochimie du St John’s College de Cambridge. Objecteur de conscience, il est resté à l’Université de Cambridge pendant la Seconde Guerre mondiale pour étudier les bienfaits nutritionnels de la lysine dans les pommes de terre sous la direction du biochimiste Albert Neuberger. En 1940, Sanger épouse Margaret Joan Howe, diplômée en économie. Ils ont eu trois enfants et sont restés mariés jusqu’à sa mort en 2012. Sanger a attribué à sa femme et à ses collègues chercheurs des rôles clés dans son succès. Après avoir obtenu son doctorat en 1943, Sanger a commencé la recherche qui a conduit à son premier prix Nobel, en étudiant comment les acides aminés se lient dans les deux chaînes polypeptidiques de l’insuline. Il a marqué les extrémités des chaînes séparées avec un colorant jaune, puis les a hydrolysées en acides aminés et a identifié l’acide aminé marqué dans chaque cas. Après avoir utilisé de l’acide et des enzymes pour diviser chaque chaîne en fragments définis, il a marqué les fragments purifiés avec le colorant et a répété le processus. À partir de cela et de la composition en acides aminés des fragments, il a déduit l’ordre des acides aminés dans la protéine intacte, un peu comme si on construisait une image à partir des pièces d’un puzzle.
Il a développé un intérêt pour la science grâce à son père médecin et à son frère aîné, avec qui il aimait le plein air. En 1939, il est diplômé en biochimie du St John’s College de Cambridge. Objecteur de conscience, il est resté à l’Université de Cambridge pendant la Seconde Guerre mondiale pour étudier les bienfaits nutritionnels de la lysine dans les pommes de terre sous la direction du biochimiste Albert Neuberger. En 1940, Sanger épouse Margaret Joan Howe, diplômée en économie. Ils ont eu trois enfants et sont restés mariés jusqu’à sa mort en 2012. Sanger a attribué à sa femme et à ses collègues chercheurs des rôles clés dans son succès. Après avoir obtenu son doctorat en 1943, Sanger a commencé la recherche qui a conduit à son premier prix Nobel, en étudiant comment les acides aminés se lient dans les deux chaînes polypeptidiques de l’insuline. Il a marqué les extrémités des chaînes séparées avec un colorant jaune, puis les a hydrolysées en acides aminés et a identifié l’acide aminé marqué dans chaque cas. Après avoir utilisé de l’acide et des enzymes pour diviser chaque chaîne en fragments définis, il a marqué les fragments purifiés avec le colorant et a répété le processus. À partir de cela et de la composition en acides aminés des fragments, il a déduit l’ordre des acides aminés dans la protéine intacte, un peu comme si on construisait une image à partir des pièces d’un puzzle. Sanger préférait être en retrait mais n’avait pas peur d’utiliser son influence. Il a soutenu une offre réussie à l’UK Medical Research Council (MRC) pour construire le Laboratoire de biologie moléculaire à Cambridge, qui a ouvert ses portes en 1962. Ici, Sanger a passé le reste de sa vie scientifique active. Après avoir d’abord trouvé des moyens de séquencer les molécules d’ARN, par lesquelles les informations de séquence dans les gènes sont transférées dans les séquences de protéines, Sanger a relevé le défi de séquencer les gènes eux-mêmes.
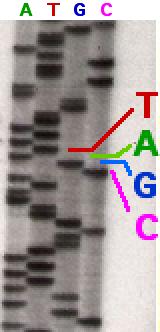
Sanger préférait être en retrait mais n’avait pas peur d’utiliser son influence. Il a soutenu une offre réussie à l’UK Medical Research Council (MRC) pour construire le Laboratoire de biologie moléculaire à Cambridge, qui a ouvert ses portes en 1962. Ici, Sanger a passé le reste de sa vie scientifique active. Après avoir d’abord trouvé des moyens de séquencer les molécules d’ARN, par lesquelles les informations de séquence dans les gènes sont transférées dans les séquences de protéines, Sanger a relevé le défi de séquencer les gènes eux-mêmes.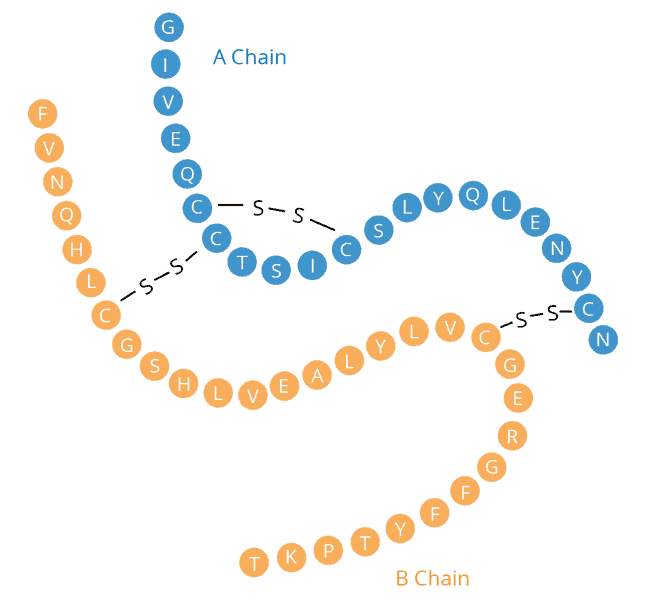 Il a développé une méthode qui utilisait des enzymes pour copier des fragments d’ADN. Quatre réactions ont été mises en place côte à côte, chacune dotée des quatre blocs de construction standard, ou nucléotides, (As, Cs, Gs et Ts), dont l’un était marqué avec des atomes radioactifs. Les réactions contenaient également une version modifiée de A, C, G ou T. Chaque réaction contenait également une version modifiée de A, C, G ou T. Contrairement aux nucléotides standard, ces « terminateurs de chaîne » ne permettaient pas au brin d’ADN de se développer davantage après leur incorporation. Les copies interrompues ont été séparées selon leur taille sur des gels par un courant électrique et exposées à un film photographique, permettant à la radioactivité de produire les «échelles» désormais emblématiques de bandes sombres. Ces bandes révélaient la longueur de la copie d’ADN et permettaient une lecture simple de la séquence. En combinant des séquences de nombreux fragments d’ADN, la séquence de la plus grande molécule d’ADN à partir de laquelle les fragments ont été dérivés a pu être déduite.
Il a développé une méthode qui utilisait des enzymes pour copier des fragments d’ADN. Quatre réactions ont été mises en place côte à côte, chacune dotée des quatre blocs de construction standard, ou nucléotides, (As, Cs, Gs et Ts), dont l’un était marqué avec des atomes radioactifs. Les réactions contenaient également une version modifiée de A, C, G ou T. Chaque réaction contenait également une version modifiée de A, C, G ou T. Contrairement aux nucléotides standard, ces « terminateurs de chaîne » ne permettaient pas au brin d’ADN de se développer davantage après leur incorporation. Les copies interrompues ont été séparées selon leur taille sur des gels par un courant électrique et exposées à un film photographique, permettant à la radioactivité de produire les «échelles» désormais emblématiques de bandes sombres. Ces bandes révélaient la longueur de la copie d’ADN et permettaient une lecture simple de la séquence. En combinant des séquences de nombreux fragments d’ADN, la séquence de la plus grande molécule d’ADN à partir de laquelle les fragments ont été dérivés a pu être déduite. Sanger a démontré la puissance de sa méthode en séquençant des génomes de taille toujours croissante, en commençant par un simple virus bactérien (5 386 nucléotides) en 1977, puis l’ADN des mitochondries des cellules humaines (16 569 nucléotides) en 1981 et, enfin, le génome d’un virus bactérien complexe, le bactériophage lambda (48 502 nucléotides), en 1982. En 1993, neuf ans après la retraite de Sanger, le Wellcome Trust et le MRC ont ouvert le Sanger Center (maintenant le Wellcome Trust Sanger Institute) près de Cambridge, où une partie considérable du génome humain a été décodée avec la technique qu’il a développée. Dans les années 2000, le séquençage Sanger a progressivement cédé la place à des techniques plus rapides et moins chères qui détectent les nucléotides lorsqu’ils se fixent sur des brins d’ADN en croissance. Mais le séquençage Sanger reste l’étalon-or. La technique très précise est de plus en plus appliquée aux génomes d’humains individuels et même à des cellules individuelles au sein de tumeurs. L’impact de Sanger sur la biologie est aussi dramatique que celui de Charles Darwin.
Sanger a démontré la puissance de sa méthode en séquençant des génomes de taille toujours croissante, en commençant par un simple virus bactérien (5 386 nucléotides) en 1977, puis l’ADN des mitochondries des cellules humaines (16 569 nucléotides) en 1981 et, enfin, le génome d’un virus bactérien complexe, le bactériophage lambda (48 502 nucléotides), en 1982. En 1993, neuf ans après la retraite de Sanger, le Wellcome Trust et le MRC ont ouvert le Sanger Center (maintenant le Wellcome Trust Sanger Institute) près de Cambridge, où une partie considérable du génome humain a été décodée avec la technique qu’il a développée. Dans les années 2000, le séquençage Sanger a progressivement cédé la place à des techniques plus rapides et moins chères qui détectent les nucléotides lorsqu’ils se fixent sur des brins d’ADN en croissance. Mais le séquençage Sanger reste l’étalon-or. La technique très précise est de plus en plus appliquée aux génomes d’humains individuels et même à des cellules individuelles au sein de tumeurs. L’impact de Sanger sur la biologie est aussi dramatique que celui de Charles Darwin.
Sanger était le plus heureux sur la paillasse du laboratoire, où il travaillait sans relâche et avec détermination. Il a réalisé des expériences élégantes avec des appareils simples pour résoudre des problèmes extrêmement difficiles. Ce faisant, il a inspiré de jeunes scientifiques et attiré certains des meilleurs biologistes du monde à Cambridge. Sanger était notoirement discret, mais il savait qu’il était un scientifique extraordinaire, et quand l’occasion l’exigeait, il était prêt à le dire. Lorsque des collègues se sont réunis après l’annonce de son deuxième prix Nobel, on a loué sa modestie caractéristique. Sanger a répondu : « Je veux que vous sachiez tous que je pense que je suis sacrément bon. » Il a été comblé de récompenses et a tranquillement apprécié la reconnaissance. Après sa retraite, il continue à construire des bateaux et développe un magnifique jardin à l’anglaise.
Frederick Sanger : homme de méthode, solutionneur de problèmes  L’éclat du travail de Frederick Sanger ne réside pas dans ce qu’il a découvert mais dans la façon dont il l’a découvert. Expérimentateur qualifié, il a développé de nouvelles techniques de séquençage des protéines et de l’ADN qui ont révolutionné la science et sont toujours utilisées aujourd’hui. Un étudiant moyen. Frederick Sanger est né le 13 août 1918 à Rendcombe, en Angleterre, d’un père médecin et de la riche fille d’un fabricant de coton. Enfant, il aimait la menuiserie, mais l’amour de son père pour la science a suscité son intérêt et il s’est inscrit à l’Université de Cambridge pour étudier la chimie et la physique. Il était un étudiant moyen et trouvait la physique trop difficile ; par conséquent, il a commencé la physiologie et s’est inscrit à un tout nouveau cours appelé « biochimie », où il a excellé.
L’éclat du travail de Frederick Sanger ne réside pas dans ce qu’il a découvert mais dans la façon dont il l’a découvert. Expérimentateur qualifié, il a développé de nouvelles techniques de séquençage des protéines et de l’ADN qui ont révolutionné la science et sont toujours utilisées aujourd’hui. Un étudiant moyen. Frederick Sanger est né le 13 août 1918 à Rendcombe, en Angleterre, d’un père médecin et de la riche fille d’un fabricant de coton. Enfant, il aimait la menuiserie, mais l’amour de son père pour la science a suscité son intérêt et il s’est inscrit à l’Université de Cambridge pour étudier la chimie et la physique. Il était un étudiant moyen et trouvait la physique trop difficile ; par conséquent, il a commencé la physiologie et s’est inscrit à un tout nouveau cours appelé « biochimie », où il a excellé.
Insuline. Sanger a obtenu son doctorat en étudiant le métabolisme de l’acide aminé lysine, puis il est passé à l’étude de l’insuline. Les protéines comme l’insuline sont constituées de chaînes d’acides aminés. Sanger s’est vu confier le défi de déterminer la séquence d’acides aminés de l’insuline, ce qui n’avait jamais été fait auparavant. En utilisant la chimie et la chromatographie, et en mélangeant des techniques standard avec de nouvelles, il a développé une méthode pour lire la séquence d’acides aminés de l’insuline et a découvert que cette protéine est en fait composée de deux chaînes d’acides aminés liées entre elles par des liaisons disulfures. Prix Nobel, prenez-en un. Il faut souvent de nombreuses années, voire des décennies, avant que le travail d’un scientifique soit reconnu comme révolutionnaire. Sanger, cependant, n’a pas eu à attendre longtemps. Dès que sa découverte a été publiée, l’étude des protéines a été révolutionnée et Sanger a reçu le prix Nobel de chimie en 1958 à peine trois ans après sa publication.
La méthode Sanger
Le prochain chapitre majeur de la vie de Sanger a commencé en 1962 lorsqu’il a rejoint le Medical Research Council (MRC) et a travaillé avec des chercheurs, tels que Francis Crick, qui étudiaient l’ADN. L’enthousiasme de Crick pour le sujet était fascinant et bientôt Sanger avait quitté l’étude des protéines pour le défi du séquençage de l’ADN. Une fois de plus, Sanger a combiné l’ancien avec le nouveau et a développé une méthode originale de séquençage de l’ADN, maintenant connue sous le nom de méthode Sanger. En 1977, lui et ses collègues ont publié la séquence d’un génome viral de plus de 5 000 paires de bases.
Prix Nobel, prenez-en deux. L’utilisation de la méthode Sanger est devenue courante et courante en biologie moléculaire. Il a depuis été automatisé et informatisé ; il a été utilisé dans le Humane Genome Project. En 1980, Sanger a reçu son deuxième prix Nobel de chimie pour ses contributions à l’étude de l’ADN.
Quitter le banc. Sanger se considère comme un expérimentateur plutôt qu’un théoricien, se sentant toujours plus à l’aise sur le banc que d’écrire ou d’enseigner. Il a pris sa retraite en 1983 et depuis, il aime jardiner et faire du bateau avec sa femme et ses trois enfants. Le Wellcome Trust Sanger Institute près de Cambridge porte son nom et poursuit des recherches à grande échelle sur le génome.
Frederick Sanger (1918-2013)
Biochimiste anglais qui a reçu deux fois le prix Nobel de chimie. Il a reçu le prix en 1958 pour ses travaux sur la structure des protéines, en particulier la détermination de la structure de la molécule d’insuline. Il a partagé le prix (avec Paul Berg et Walter Gilbert des États-Unis) en 1980 pour sa contribution concernant la détermination des séquences de bases dans les acides nucléiques.
https://www.nature.com/scitable/topicpage/frederick-sanger-method-man-problem-solver-6537485/
https://www.nobelprize.org/prizes/chemistry/1958/sanger/biographical/
https://todayinsci.com/11/11_19.htm#death