 Boyer, lauréat du prix Nobel pour la recherche sur le « mécanisme enzymatique sous-jacent à la biosynthèse de l’adénosine triphosphate (ATP) » en 1997
Boyer, lauréat du prix Nobel pour la recherche sur le « mécanisme enzymatique sous-jacent à la biosynthèse de l’adénosine triphosphate (ATP) » en 1997 Paul Delos Boyer (1919-2018), biologiste moléculaire américain, a partagé le prix Nobel de chimie 1997 avec 2 autres biochimistes, John E. Walker (1941) de Grande-Bretagne et Jens C. Skou (1918-2018) du Danemark, pour leurs découvertes sur l’ATP synthase, une enzyme responsable de la fabrication de l’adénosine triphosphate (ATP), le vecteur énergétique universel des cellules vivantes. Au moyen de liaisons chimiques riches en énergie, l’ATP capture l’énergie chimique libérée par les aliments et la met à la disposition des cellules pour la contraction des muscles, la transmission de l’influx nerveux, la construction des composants cellulaires et d’autres processus. Boyer a travaillé à l’Université de Californie à Los Angeles, Walker au Medical Research Council Laboratory of Molecular Biology à l’Université de Cambridge en Angleterre et Skou à l’Université d’Aarhus (Danemark).
Paul Delos Boyer (1919-2018), biologiste moléculaire américain, a partagé le prix Nobel de chimie 1997 avec 2 autres biochimistes, John E. Walker (1941) de Grande-Bretagne et Jens C. Skou (1918-2018) du Danemark, pour leurs découvertes sur l’ATP synthase, une enzyme responsable de la fabrication de l’adénosine triphosphate (ATP), le vecteur énergétique universel des cellules vivantes. Au moyen de liaisons chimiques riches en énergie, l’ATP capture l’énergie chimique libérée par les aliments et la met à la disposition des cellules pour la contraction des muscles, la transmission de l’influx nerveux, la construction des composants cellulaires et d’autres processus. Boyer a travaillé à l’Université de Californie à Los Angeles, Walker au Medical Research Council Laboratory of Molecular Biology à l’Université de Cambridge en Angleterre et Skou à l’Université d’Aarhus (Danemark). Boyer est né le 31 juillet 1918 à Provo, dans le centre-nord de l’Utah, à environ 40 miles au sud-est de Salt Lake City. Son père était médecin ostéopathe ; Boyer avait 5 frères et sœurs. Sa mère est décédée à l’âge de 45 ans, alors que Boyer avait 15 ans. Il a fréquenté les écoles publiques de Provo puis est entré à l’Université Brigham Young. Boyer a obtenu le diplôme BS en 1939. Il a remporté une bourse de la Wisconsin Alumni Research Foundation et est entré à l’Université du Wisconsin à Madison pour des études supérieures. Il a été assistant chercheur en biochimie de 1939 à 1943. Boyer a obtenu une maîtrise en 1941 et un doctorat en biochimie en 1943.
Boyer est né le 31 juillet 1918 à Provo, dans le centre-nord de l’Utah, à environ 40 miles au sud-est de Salt Lake City. Son père était médecin ostéopathe ; Boyer avait 5 frères et sœurs. Sa mère est décédée à l’âge de 45 ans, alors que Boyer avait 15 ans. Il a fréquenté les écoles publiques de Provo puis est entré à l’Université Brigham Young. Boyer a obtenu le diplôme BS en 1939. Il a remporté une bourse de la Wisconsin Alumni Research Foundation et est entré à l’Université du Wisconsin à Madison pour des études supérieures. Il a été assistant chercheur en biochimie de 1939 à 1943. Boyer a obtenu une maîtrise en 1941 et un doctorat en biochimie en 1943.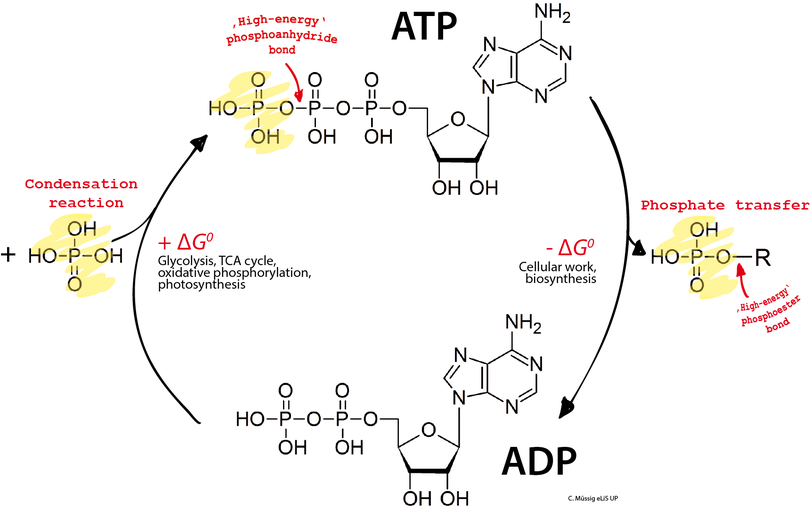 En 1943, Boyer a rejoint la faculté de l’Université de Stanford à Palo Alto, en Californie, où il a travaillé sur un projet de recherche lié à la guerre consacré à la stabilisation de l’albumine sérique pour les transfusions sanguines. En 1945, il est devenu professeur adjoint à l’Université du Minnesota à Minneapolis et a commencé des recherches indépendantes.
En 1943, Boyer a rejoint la faculté de l’Université de Stanford à Palo Alto, en Californie, où il a travaillé sur un projet de recherche lié à la guerre consacré à la stabilisation de l’albumine sérique pour les transfusions sanguines. En 1945, il est devenu professeur adjoint à l’Université du Minnesota à Minneapolis et a commencé des recherches indépendantes. En 1955-1956, Boyer était boursier Guggenheim à l’université et, de 1956 à 1963, il était professeur de recherche Hill à la faculté de médecine de l’université.
En 1955-1956, Boyer était boursier Guggenheim à l’université et, de 1956 à 1963, il était professeur de recherche Hill à la faculté de médecine de l’université.
En 1963, Boyer a été nommé professeur de chimie à l’Université de Californie à Los Angeles (UCLA), où il a été directeur de l’Institut de biologie moléculaire de 1965 à 1983 et directeur du programme biochimique de 1983 à 1989. De 1963 à 1989, il était rédacteur en chef adjoint ou rédacteur en chef de l’Annual Review of Biochemistry. En 1990, Boyer est devenu professeur émérite de chimie et de biologie à l’UCLA. Lorsque Boyer a commencé ses recherches sur la formation d’ATP au début des années 1950, les scientifiques savaient que l’ATP était le vecteur énergétique des cellules vivantes. L’adénosine triphosphate est constituée d’une molécule d’adénosine liée par des liaisons à haute énergie à une chaîne de 3 groupes phosphate. L’élimination d’un groupe phosphate libère l’énergie stockée pour une utilisation par les cellules. Dans le processus, l’ATP devient l’adénosine diphosphate (ADP). Avec l’aide de l’énergie chimique dans les aliments, un phosphate peut être ajouté à l’ADP, produisant plus d’ATP. À la fin des années 1970, Boyer a proposé «l’hypothèse du changement de liaison», une élucidation détaillée du mécanisme par lequel l’ATPase catalyse la synthèse de l’ATP à partir de l’ADP et du phosphate.
Lorsque Boyer a commencé ses recherches sur la formation d’ATP au début des années 1950, les scientifiques savaient que l’ATP était le vecteur énergétique des cellules vivantes. L’adénosine triphosphate est constituée d’une molécule d’adénosine liée par des liaisons à haute énergie à une chaîne de 3 groupes phosphate. L’élimination d’un groupe phosphate libère l’énergie stockée pour une utilisation par les cellules. Dans le processus, l’ATP devient l’adénosine diphosphate (ADP). Avec l’aide de l’énergie chimique dans les aliments, un phosphate peut être ajouté à l’ADP, produisant plus d’ATP. À la fin des années 1970, Boyer a proposé «l’hypothèse du changement de liaison», une élucidation détaillée du mécanisme par lequel l’ATPase catalyse la synthèse de l’ATP à partir de l’ADP et du phosphate.
Outre le prix Nobel, Boyer a reçu de nombreux honneurs et récompenses, dont le Rose Award de l’American Society of Chemistry and Molecular Biology en 1989 et des doctorats honorifiques des universités de Stockholm (1974), du Minnesota (1996) et du Wisconsin (1998). En 2002, le Ghana a honoré Boyer par l’émission d’un timbre.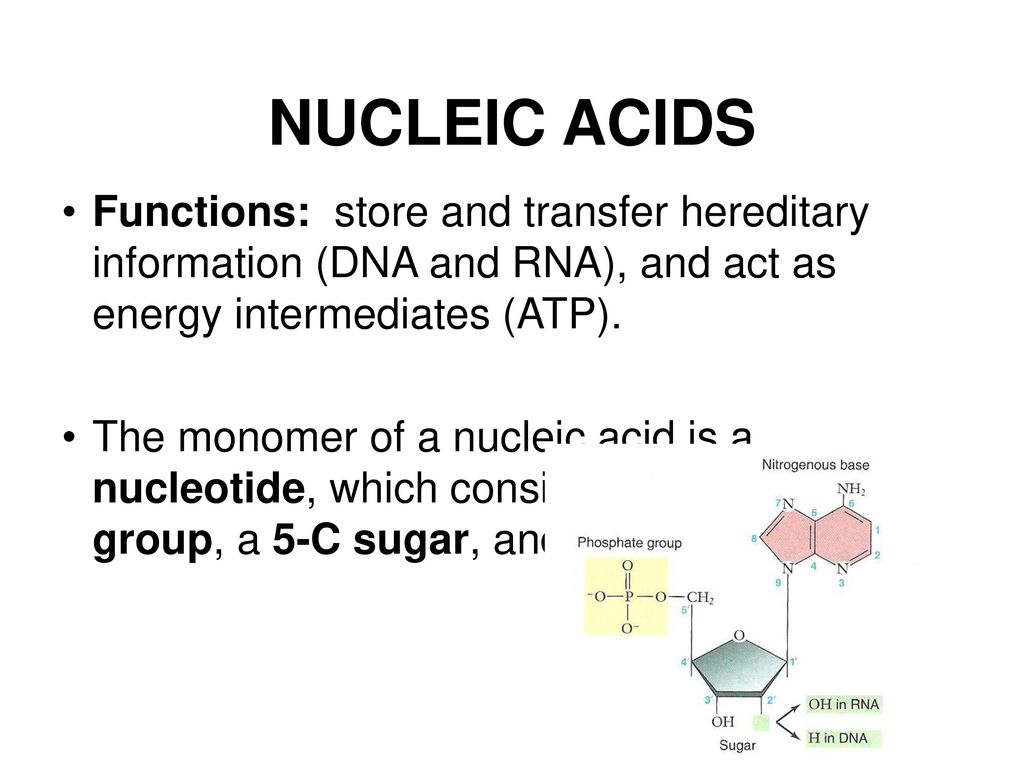 À propos de mécanisme enzymatique sous-jacent à la biosynthèse de l’adénosine triphosphate (ATP)
À propos de mécanisme enzymatique sous-jacent à la biosynthèse de l’adénosine triphosphate (ATP)
ATP : qu’est-ce que c’est ? L’ATP ou, adénosine triphosphate, est un nucléotide de la famille des purines servant à emmagasiner et à transporter de l’énergie (les purines sont des bases azotées). Il est constitué de l’adénine (une base azotée), du ribose (un sucre avec cinq atomes de carbone) et de trois groupes phosphates unis les uns aux autres par deux liaisons pyrophosphates à haut potentiel énergétique.
L’ATP ou, adénosine triphosphate, est un nucléotide de la famille des purines servant à emmagasiner et à transporter de l’énergie (les purines sont des bases azotées). Il est constitué de l’adénine (une base azotée), du ribose (un sucre avec cinq atomes de carbone) et de trois groupes phosphates unis les uns aux autres par deux liaisons pyrophosphates à haut potentiel énergétique.
Dans la cellule, les stocks d’ATP sont peu importants, la molécule doit donc être continuellement renouvelée. La respiration cellulaire, impliquant les mitochondries, permet la formation de nouvelles molécules d’ATP. Chez les végétaux, la photosynthèse produit également de l’ATP dans les chloroplastes.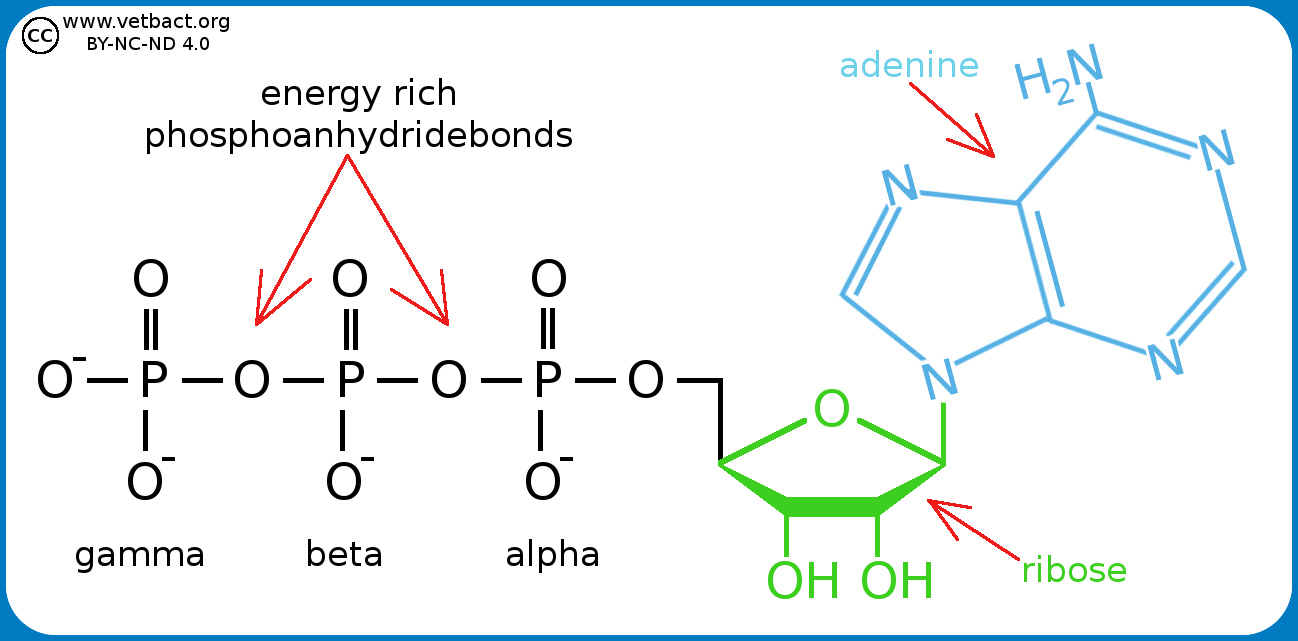 Les rôles de l’ATP : énergie, synthèse d’acides nucléiques…
Les rôles de l’ATP : énergie, synthèse d’acides nucléiques…
L’ATP est une molécule qui joue de nombreux rôles dans l’organisme :
L’ATP est une molécule qui fournit de l’énergie à la cellule, grâce à la rupture d’une liaison phospho-diester. Cette hydrolyse de la molécule d’ATP libère de l’ADP (adénosine diphosphate) et permet le transfert d’un groupement phosphate vers une autre molécule, L’ATP présent dans la cellule peut servir à la synthèse d’acides nucléiques (ARN), tout comme les nucléotides GTP, CTP, et UTP. Pour l’ADN, les nucléotides utilisés sont des désoxyribonucléotides (avec un sucre désoxyribose à la place du ribose),
L’ATP présent dans la cellule peut servir à la synthèse d’acides nucléiques (ARN), tout comme les nucléotides GTP, CTP, et UTP. Pour l’ADN, les nucléotides utilisés sont des désoxyribonucléotides (avec un sucre désoxyribose à la place du ribose),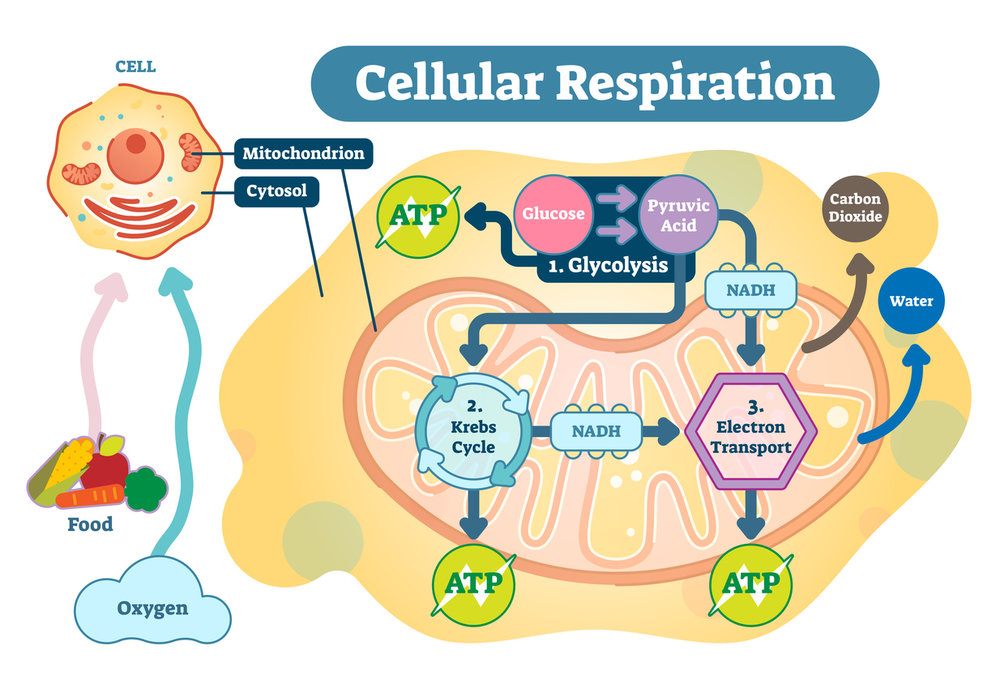
L’ATP participe à de nombreuses voies de régulation, grâce à la phosphorylation (ajout d’un groupement phosphate). La phosphorylation d’une enzyme peut l’activer ou l’inhiber. Par exemple, la glycogène synthase, impliquée dans la synthèse du glycogène, est inactive à l’état phosphorylé et active à l’état déphosphorylé.
Cristallographie – Qu’est-ce que la cristallographie ? La branche de la science qui examine l’arrangement des atomes dans un solide.
La branche de la science qui examine l’arrangement des atomes dans un solide.
Le terme « cristallographie » vient des mots grecs crystallon qui signifie « goutte froide » ou « goutte gelée » et grapho qui signifie « j’écris »
Un cristal est un morceau d’une substance solide homogène ayant une forme géométrique naturelle régulière avec des faces planes disposées de façon symétrique.
La découverte du mécanisme enzymatique à la base de la synthèse de l’adénosine triphosphate (ATP)
En 1997, le prix Nobel de chimie a été attribué pour moitié au professeur Paul D. Boyer, de l’université de Californie à Los Angeles (États-Unis), et au Dr John E. Walker, du Medical Research Council Laboratory of Molecular Biology de Cambridge (Royaume-Uni), pour l’élucidation du mécanisme enzymatique qui sous-tend la synthèse de l’adénosine triphosphate (ATP), et pour moitié au professeur Jens C. Skou, de l’université d’Aarhus (Danemark), pour la première découverte d’une enzyme de transport d’ions, la Na + , K + -ATPase. Les trois lauréats ont effectué un travail de pionnier sur les enzymes qui participent à la conversion du composé « hautement énergétique » qu’est l’adénosine triphosphate (ATP).  Paul D. Boyer et John E. Walker reçoivent la moitié du prix pour leurs travaux sur la façon dont l’enzyme ATP synthase catalyse la formation de l’ATP. Boyer et ses collaborateurs ont proposé, sur les bases de données biochimiques, un mécanisme de formation de l’ATP à partir de l’adénosine diphosphate (ADP) et du phosphate inorganique. Walker et ses collaborateurs ont établi la structure de l’enzyme et vérifié le mécanisme proposé par Boyer. Jens C. Skou reçoit sa moitié du prix pour la découverte de l’enzyme adénosine triphosphatase stimulée par le sodium et le potassium (Na + , K + -ATPase). Cette enzyme maintient l’équilibre des ions sodium et potassium dans la cellule vivante. Les deux enzymes sont liées aux membranes de la cellule et au transport des ions à travers celles-ci, mais pour des raisons différentes.
Paul D. Boyer et John E. Walker reçoivent la moitié du prix pour leurs travaux sur la façon dont l’enzyme ATP synthase catalyse la formation de l’ATP. Boyer et ses collaborateurs ont proposé, sur les bases de données biochimiques, un mécanisme de formation de l’ATP à partir de l’adénosine diphosphate (ADP) et du phosphate inorganique. Walker et ses collaborateurs ont établi la structure de l’enzyme et vérifié le mécanisme proposé par Boyer. Jens C. Skou reçoit sa moitié du prix pour la découverte de l’enzyme adénosine triphosphatase stimulée par le sodium et le potassium (Na + , K + -ATPase). Cette enzyme maintient l’équilibre des ions sodium et potassium dans la cellule vivante. Les deux enzymes sont liées aux membranes de la cellule et au transport des ions à travers celles-ci, mais pour des raisons différentes.
Paul Delos Boyer (1919-2018)![Modern Experimental Biochemistry )] [by: Rodney F. Boyer] [Aug-2000] - Boyer: 9788177588842 - IberLibro](https://pictures.abebooks.com/isbn/9788177588842-es.jpg) Biochimiste américain qui, avec John E. Walker, a reçu la moitié du prix Nobel de chimie 1997 pour ses travaux expliquant le processus enzymatique impliqué dans la production de la molécule de stockage de l’énergie, l’adénosine triphosphate (ATP), qui alimente les processus métaboliques des cellules de tous les êtres vivants, et comment l’enzyme ATP synthase catalyse la formation de l’ATP. Boyer et ses collaborateurs ont proposé, sur la base de données biochimique, un mécanisme de formation de l’ATP à partir de l’adénosine diphosphate (ADP) et du phosphate inorganique. Walker et ses collaborateurs ont établi la structure de l’enzyme et vérifié le mécanisme proposé par Boyer.
Biochimiste américain qui, avec John E. Walker, a reçu la moitié du prix Nobel de chimie 1997 pour ses travaux expliquant le processus enzymatique impliqué dans la production de la molécule de stockage de l’énergie, l’adénosine triphosphate (ATP), qui alimente les processus métaboliques des cellules de tous les êtres vivants, et comment l’enzyme ATP synthase catalyse la formation de l’ATP. Boyer et ses collaborateurs ont proposé, sur la base de données biochimique, un mécanisme de formation de l’ATP à partir de l’adénosine diphosphate (ADP) et du phosphate inorganique. Walker et ses collaborateurs ont établi la structure de l’enzyme et vérifié le mécanisme proposé par Boyer.
https://www.futura-sciences.com/sante/definitions/genetique-atp-661/
https://www.sutori.com/en/item/untitled-8dcc-bfdc