 Découverte de l’hydrogène par Cavendish
Découverte de l’hydrogène par Cavendish Henry Cavendish, physicien et chimiste britannique (découverte de l’hydrogène)
Henry Cavendish, physicien et chimiste britannique (découverte de l’hydrogène)
 Il portait toujours les mêmes habits et se servit pendant 30 ans du même chapeau. Refusant de se laisser peindre, il n’existe aucun portrait officiel de lui et les seules représentations sont des esquisses effectuées au cours de dîners. Les traits de sa personnalité sont en accord avec un syndrome d’Asperger. En 1798 il fut le premier à mesurer la constante gravitationnelle de Newton par une expérience suggérée par John Michell, qui est restée célèbre, et à déterminer ainsi la masse de la Terre. Il fut l’un des fondateurs de la chimie moderne par la méthode et la précision des mesures qu’il s’imposa dans ses expériences. Il travailla dans d’autres domaines comme l’électrostatique quantitative (c’est un contemporain de Coulomb), ce qui lui permit de poser des bases sur lesquelles les physiciens du XIXe siècle purent développer leurs recherches. Toutefois l’étendue de son génie ne fut connue que dans les années 1870, lorsque Maxwell eut dépouillé les documents qu’il avait laissés 60 ans auparavant.
Il portait toujours les mêmes habits et se servit pendant 30 ans du même chapeau. Refusant de se laisser peindre, il n’existe aucun portrait officiel de lui et les seules représentations sont des esquisses effectuées au cours de dîners. Les traits de sa personnalité sont en accord avec un syndrome d’Asperger. En 1798 il fut le premier à mesurer la constante gravitationnelle de Newton par une expérience suggérée par John Michell, qui est restée célèbre, et à déterminer ainsi la masse de la Terre. Il fut l’un des fondateurs de la chimie moderne par la méthode et la précision des mesures qu’il s’imposa dans ses expériences. Il travailla dans d’autres domaines comme l’électrostatique quantitative (c’est un contemporain de Coulomb), ce qui lui permit de poser des bases sur lesquelles les physiciens du XIXe siècle purent développer leurs recherches. Toutefois l’étendue de son génie ne fut connue que dans les années 1870, lorsque Maxwell eut dépouillé les documents qu’il avait laissés 60 ans auparavant.
 Le découvreur original de l’air inflammable, autrement connu sous le nom d’hydrogène, était notoirement timide et caché de la vue du public ; pourtant il était un chimiste incroyablement influent. Notamment, ce chercheur renommé a beaucoup travaillé dans la recherche et l’étude de divers gaz et a calculé la densité et la masse de la Terre dans une expérience connue sous le nom d’expérience Cavendish.
Le découvreur original de l’air inflammable, autrement connu sous le nom d’hydrogène, était notoirement timide et caché de la vue du public ; pourtant il était un chimiste incroyablement influent. Notamment, ce chercheur renommé a beaucoup travaillé dans la recherche et l’étude de divers gaz et a calculé la densité et la masse de la Terre dans une expérience connue sous le nom d’expérience Cavendish.
La découverte de l’hydrogène 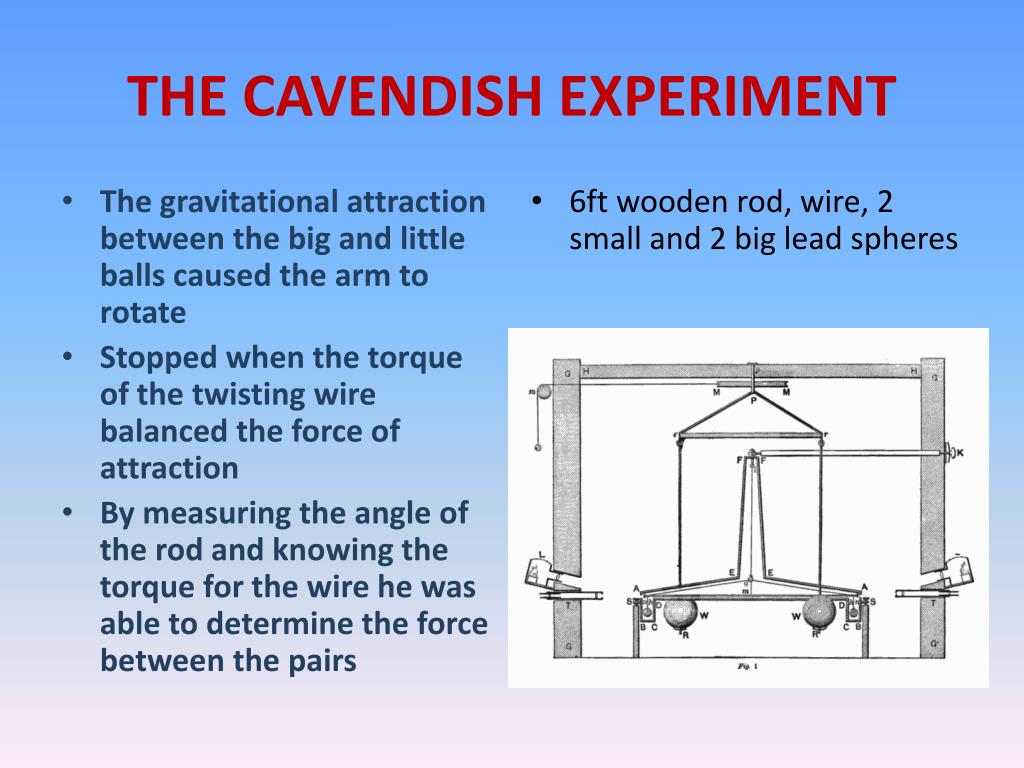 En 1766, Cavendish enquêtait sur les doutes des grands esprits de l’époque selon lesquels l’eau et l’oxygène étaient les seuls éléments de base. Tout en faisant des expériences, il a isolé l’hydrogène et l’a identifié comme un élément unique. La compréhension scientifique des gaz à l’époque était primitive et Cavendish a fait référence à deux types d’air, appelés air fixe et air inflammable. Air fixe sous forme de dioxyde de carbone et air inflammable sous forme d’hydrogène. L’hydrogène était hautement inflammable, ce qui l’a amené à se référer au gaz comme «air inflammable». Lors de sa découverte, il a même deviné que les molécules d’hydrogène étaient proportionnées deux à une dans l’eau, que nous entendons maintenant par H20. Si vous voulez jeter un coup d’œil aux expériences spécifiques entreprises par Henry Cavendish pour découvrir l’hydrogène, la BBC a un segment étonnant qui les recrée avec le célèbre Brian Cox.
En 1766, Cavendish enquêtait sur les doutes des grands esprits de l’époque selon lesquels l’eau et l’oxygène étaient les seuls éléments de base. Tout en faisant des expériences, il a isolé l’hydrogène et l’a identifié comme un élément unique. La compréhension scientifique des gaz à l’époque était primitive et Cavendish a fait référence à deux types d’air, appelés air fixe et air inflammable. Air fixe sous forme de dioxyde de carbone et air inflammable sous forme d’hydrogène. L’hydrogène était hautement inflammable, ce qui l’a amené à se référer au gaz comme «air inflammable». Lors de sa découverte, il a même deviné que les molécules d’hydrogène étaient proportionnées deux à une dans l’eau, que nous entendons maintenant par H20. Si vous voulez jeter un coup d’œil aux expériences spécifiques entreprises par Henry Cavendish pour découvrir l’hydrogène, la BBC a un segment étonnant qui les recrée avec le célèbre Brian Cox. Il convient de noter que la découverte de l’hydrogène par Cavendish était simplement la première fois que le gaz qu’il isolait était reconnu comme un élément unique. L’hydrogène gazeux a été créé pour la première fois par Robert Boyle et d’autres plusieurs années plus tôt, mais ils n’ont pas reconnu ce gaz inflammable comme son propre élément. À la fin des années 1800, les scientifiques croyaient qu’il y avait un élément dans l’air appelé phlogistique. C’est une théorie aujourd’hui disparue, mais elle déclarait que les éléments contenant du phlogistique étaient inflammables. Lors du processus de combustion, le phlogistique était libéré et l’élément brûlé pouvait être considéré comme déphlogistiqué.
Il convient de noter que la découverte de l’hydrogène par Cavendish était simplement la première fois que le gaz qu’il isolait était reconnu comme un élément unique. L’hydrogène gazeux a été créé pour la première fois par Robert Boyle et d’autres plusieurs années plus tôt, mais ils n’ont pas reconnu ce gaz inflammable comme son propre élément. À la fin des années 1800, les scientifiques croyaient qu’il y avait un élément dans l’air appelé phlogistique. C’est une théorie aujourd’hui disparue, mais elle déclarait que les éléments contenant du phlogistique étaient inflammables. Lors du processus de combustion, le phlogistique était libéré et l’élément brûlé pouvait être considéré comme déphlogistiqué.

 En 1785, Cavendish s’était bien fait un nom et a commencé à étudier d’autres propriétés de l’air. Plus précisément, Henry Cavendish a été l’un des premiers scientifiques à déterminer le rapport spécifique de l’azote et de l’oxygène dans l’air atmosphérique, soit une partie d’oxygène pour 4 parties d’azote. En rappelant notre discussion sur la chimie orientée phlogistique, si vous lisez l’un des travaux et articles de Cavendish, vous remarquerez que tout est écrit dans cette formulation. Ce n’est qu’en 1787 que Cavendish s’est éloigné de la théorie du phlogistique, l’une des premières personnes en dehors du pôle scientifique français à le faire.
En 1785, Cavendish s’était bien fait un nom et a commencé à étudier d’autres propriétés de l’air. Plus précisément, Henry Cavendish a été l’un des premiers scientifiques à déterminer le rapport spécifique de l’azote et de l’oxygène dans l’air atmosphérique, soit une partie d’oxygène pour 4 parties d’azote. En rappelant notre discussion sur la chimie orientée phlogistique, si vous lisez l’un des travaux et articles de Cavendish, vous remarquerez que tout est écrit dans cette formulation. Ce n’est qu’en 1787 que Cavendish s’est éloigné de la théorie du phlogistique, l’une des premières personnes en dehors du pôle scientifique français à le faire. 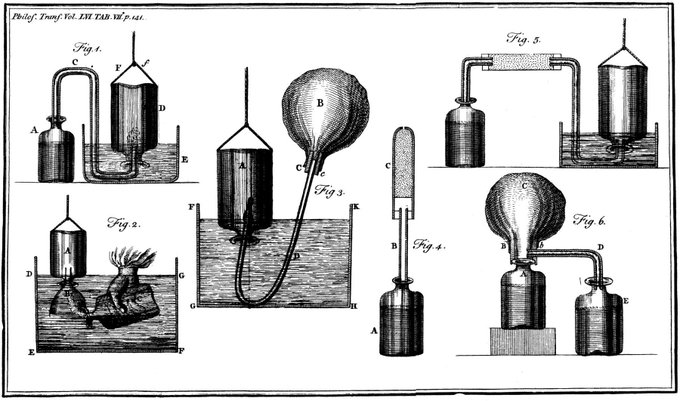
 Henri Cavendish : Philosophe de la nature, le plus grand chimiste et physicien anglais expérimental et théorique de son époque, Henry Cavendish (10 octobre 1731 – 24 février 1810) s’est distingué par sa grande exactitude et précision dans ses recherches sur la composition de l’air atmosphérique, les propriétés de différents gaz, la synthèse de l’eau, la loi régissant l’attraction et la répulsion électriques, et les calculs de la densité (et donc du poids) de la Terre.
Henri Cavendish : Philosophe de la nature, le plus grand chimiste et physicien anglais expérimental et théorique de son époque, Henry Cavendish (10 octobre 1731 – 24 février 1810) s’est distingué par sa grande exactitude et précision dans ses recherches sur la composition de l’air atmosphérique, les propriétés de différents gaz, la synthèse de l’eau, la loi régissant l’attraction et la répulsion électriques, et les calculs de la densité (et donc du poids) de la Terre.
Début de la vie: Cavendish a fréquenté l’Université de Cambridge de 1749 à 1753, mais est parti sans diplôme. Il s’est plongé dans des études scientifiques mais n’a pas pris la peine de publier un certain nombre de ses découvertes importantes car Cavendish n’était sociable qu’avec ses amis scientifiques. Même le seul portrait existant de lui a été esquissé en secret. Il a abordé la plupart de ses recherches par des mesures quantitatives. Contributions et réalisations : Il fut le premier à reconnaître le gaz hydrogène comme une substance distincte pour laquelle il calcula sa densité ainsi que les densités de plusieurs autres gaz. Il a montré que l’hydrogène produisait de la rosée, qui semblait être de l’eau, lorsqu’il était brûlé. Il a également découvert que l’hydrogène était beaucoup moins dense que l’air.
Contributions et réalisations : Il fut le premier à reconnaître le gaz hydrogène comme une substance distincte pour laquelle il calcula sa densité ainsi que les densités de plusieurs autres gaz. Il a montré que l’hydrogène produisait de la rosée, qui semblait être de l’eau, lorsqu’il était brûlé. Il a également découvert que l’hydrogène était beaucoup moins dense que l’air. 
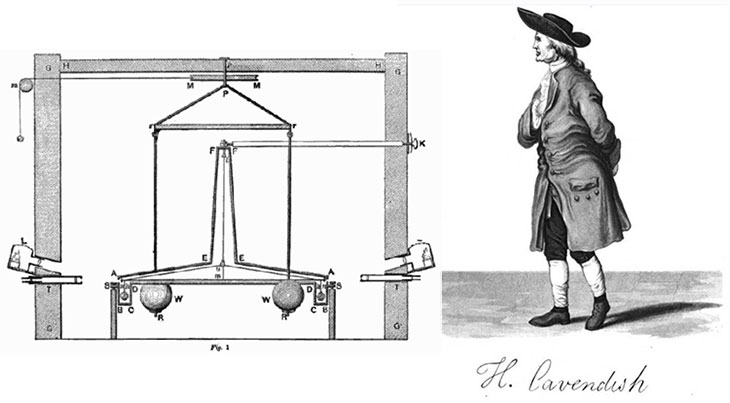
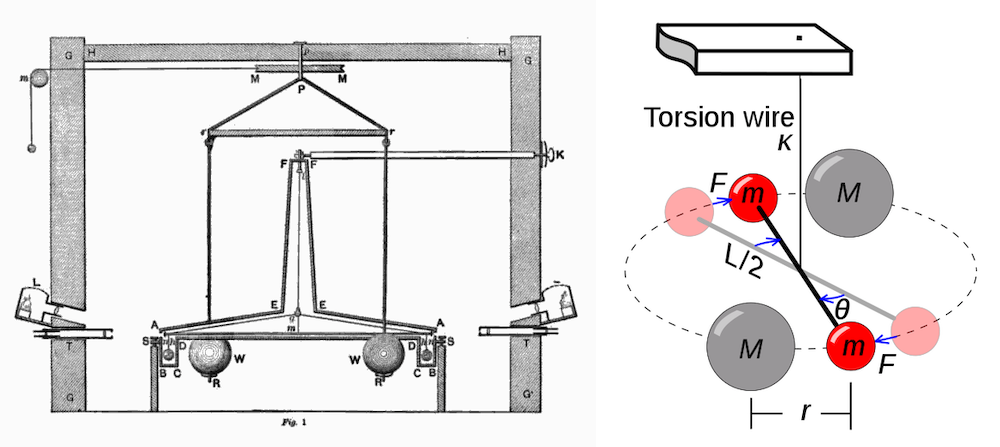 En plus de ses réalisations en chimie, Cavendish est également connu pour l’expérience Cavendish, la première à mesurer la force de gravité entre des masses en laboratoire et à produire une valeur précise de la densité de la Terre. L’appareil avec lequel il travaillait a été conçu par le révérend John Michell, bien qu’il ait fait reconstruire les parties les plus importantes selon ses propres conceptions, il dépendait de la mesure de l’attraction exercée sur une barre horizontale, suspendue par un fil vertical et portant un petit plomb. balle à chaque extrémité, par deux grosses masses de plomb. Son travail et son observation constante ont conduit d’autres à des valeurs précises pour la constante gravitationnelle (G) et la masse de la Terre. Sur la base de ses résultats, on peut calculer une valeur pour G de 6,754 × 10 -11 N·m 2 /kg 2 , qui se compare favorablement à la valeur moderne de 6,67428 × 10 -11 N·m 2 /kg 2 .
En plus de ses réalisations en chimie, Cavendish est également connu pour l’expérience Cavendish, la première à mesurer la force de gravité entre des masses en laboratoire et à produire une valeur précise de la densité de la Terre. L’appareil avec lequel il travaillait a été conçu par le révérend John Michell, bien qu’il ait fait reconstruire les parties les plus importantes selon ses propres conceptions, il dépendait de la mesure de l’attraction exercée sur une barre horizontale, suspendue par un fil vertical et portant un petit plomb. balle à chaque extrémité, par deux grosses masses de plomb. Son travail et son observation constante ont conduit d’autres à des valeurs précises pour la constante gravitationnelle (G) et la masse de la Terre. Sur la base de ses résultats, on peut calculer une valeur pour G de 6,754 × 10 -11 N·m 2 /kg 2 , qui se compare favorablement à la valeur moderne de 6,67428 × 10 -11 N·m 2 /kg 2 . Cavendish a comparé les conductivités électriques de solutions équivalentes d’électrolytes et a exprimé une version de la loi d’Ohm. Il n’a pas été le premier à approfondir une loi du carré inverse de l’attraction électrostatique, mais l’exposition de Cavendish, basée en partie sur un raisonnement mathématique, a été la plus efficace. Il fonda l’étude des propriétés des diélectriques et distingua aussi clairement la quantité d’électricité de ce qu’on appelle aujourd’hui le potentiel. L’œuvre et la réputation de Cavendish doivent être considérées en deux parties, l’une relative à son œuvre publiée, l’autre à la grande quantité qu’il n’a pas publiée. Au cours de sa vie, il a fait des découvertes notables en chimie et en physique principalement pour lesquelles il est le mieux connu et reconnu.
Cavendish a comparé les conductivités électriques de solutions équivalentes d’électrolytes et a exprimé une version de la loi d’Ohm. Il n’a pas été le premier à approfondir une loi du carré inverse de l’attraction électrostatique, mais l’exposition de Cavendish, basée en partie sur un raisonnement mathématique, a été la plus efficace. Il fonda l’étude des propriétés des diélectriques et distingua aussi clairement la quantité d’électricité de ce qu’on appelle aujourd’hui le potentiel. L’œuvre et la réputation de Cavendish doivent être considérées en deux parties, l’une relative à son œuvre publiée, l’autre à la grande quantité qu’il n’a pas publiée. Au cours de sa vie, il a fait des découvertes notables en chimie et en physique principalement pour lesquelles il est le mieux connu et reconnu. Contributions à la chimie : Au cours de sa vie, Cavendish fit des découvertes notables en chimie, principalement entre 1766 et 1788, et en électricité, entre 1771 et 1788. En 1798, il publia un seul article notable sur la densité de la terre. Au moment où Cavendish a commencé son travail chimique, les chimistes commençaient à peine à reconnaître que les « airs » qui se dégageaient dans de nombreuses réactions chimiques étaient des parties claires et pas seulement des modifications de l’air ordinaire. Cavendish a rapporté son propre travail dans « Three Papers Containing Experiments on Factitious Air » en 1766. Ces articles ont grandement contribué à la connaissance de la formation de « l’air inflammable » (hydrogène) par l’action d’acides dilués (acides qui ont été affaiblis) sur les métaux .
Contributions à la chimie : Au cours de sa vie, Cavendish fit des découvertes notables en chimie, principalement entre 1766 et 1788, et en électricité, entre 1771 et 1788. En 1798, il publia un seul article notable sur la densité de la terre. Au moment où Cavendish a commencé son travail chimique, les chimistes commençaient à peine à reconnaître que les « airs » qui se dégageaient dans de nombreuses réactions chimiques étaient des parties claires et pas seulement des modifications de l’air ordinaire. Cavendish a rapporté son propre travail dans « Three Papers Containing Experiments on Factitious Air » en 1766. Ces articles ont grandement contribué à la connaissance de la formation de « l’air inflammable » (hydrogène) par l’action d’acides dilués (acides qui ont été affaiblis) sur les métaux .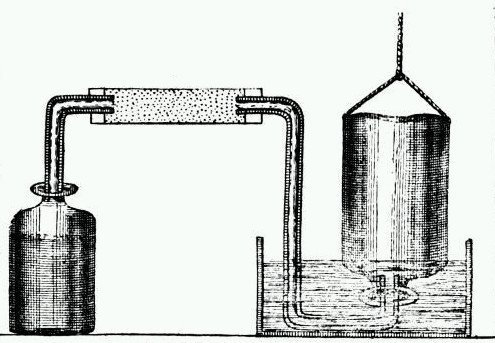
 ils sont fabriqués à partir de). Cavendish y examine également le phénomène (fait observable) de la rétention de « terre calcaire » (craie, carbonate de calcium) en solution (mélange dissous dans l’eau). Ce faisant, il a découvert la réaction réversible entre le carbonate de calcium et le dioxyde de carbone pour former du bicarbonate de calcium, la cause de la dureté temporaire de l’eau. Il a également découvert comment adoucir cette eau en ajoutant de la chaux (hydroxyde de calcium). L’une des recherches de Cavendish sur le problème actuel de la combustion (le processus de combustion) a apporté une contribution remarquable à la théorie générale. En 1784, Cavendish a déterminé la composition (constitution) de l’eau, montrant qu’il s’agissait d’une combinaison d’oxygène et d’hydrogène. Joseph Priestley (1733–1804) avait rapporté une expérience dans laquelle l’explosion des deux gaz avait laissé de l’humidité sur les côtés d’un récipient préalablement sec. Cavendish a étudié cela, a préparé de l’eau en quantité mesurable et a obtenu un chiffre approximatif pour sa composition en volume.
ils sont fabriqués à partir de). Cavendish y examine également le phénomène (fait observable) de la rétention de « terre calcaire » (craie, carbonate de calcium) en solution (mélange dissous dans l’eau). Ce faisant, il a découvert la réaction réversible entre le carbonate de calcium et le dioxyde de carbone pour former du bicarbonate de calcium, la cause de la dureté temporaire de l’eau. Il a également découvert comment adoucir cette eau en ajoutant de la chaux (hydroxyde de calcium). L’une des recherches de Cavendish sur le problème actuel de la combustion (le processus de combustion) a apporté une contribution remarquable à la théorie générale. En 1784, Cavendish a déterminé la composition (constitution) de l’eau, montrant qu’il s’agissait d’une combinaison d’oxygène et d’hydrogène. Joseph Priestley (1733–1804) avait rapporté une expérience dans laquelle l’explosion des deux gaz avait laissé de l’humidité sur les côtés d’un récipient préalablement sec. Cavendish a étudié cela, a préparé de l’eau en quantité mesurable et a obtenu un chiffre approximatif pour sa composition en volume. Recherche électrique Cavendish n’a publié qu’une fraction des preuves expérimentales dont il disposait pour étayer ses théories, mais ses pairs étaient convaincus de l’exactitude de ses conclusions. Il n’était pas le premier à discuter d’une loi du carré inverse de l’attraction électrostatique (l’attraction entre des charges électriques opposées, positives et négatives). L’idée de Cavendish, basée en partie sur un raisonnement mathématique, était cependant la plus efficace. Il a fondé l’étude des propriétés des diélectriques (électricité non conductrice) et a également distingué clairement entre la quantité d’électricité et ce qu’on appelle maintenant le potentiel.
Recherche électrique Cavendish n’a publié qu’une fraction des preuves expérimentales dont il disposait pour étayer ses théories, mais ses pairs étaient convaincus de l’exactitude de ses conclusions. Il n’était pas le premier à discuter d’une loi du carré inverse de l’attraction électrostatique (l’attraction entre des charges électriques opposées, positives et négatives). L’idée de Cavendish, basée en partie sur un raisonnement mathématique, était cependant la plus efficace. Il a fondé l’étude des propriétés des diélectriques (électricité non conductrice) et a également distingué clairement entre la quantité d’électricité et ce qu’on appelle maintenant le potentiel. Cavendish avait la capacité de faire une étude apparemment limitée donnant des résultats de grande envergure. Un exemple est son étude de l’origine de la capacité de certains poissons à donner un choc électrique. Il a composé des imitations de poisson en cuir et bois trempés dans de l’eau salée, avec des attaches en étain (étain) représentant les organes du poisson qui produisait l’effet. En utilisant des bocaux Leyden (bocaux en verre isolés avec du papier d’aluminium) pour charger les organes d’imitation, il a pu montrer que les résultats étaient tout à fait compatibles avec la capacité du poisson à produire de l’électricité. Cette enquête a été parmi les premières dans lesquelles la conductivité des solutions aqueuses (dans l’eau) a été étudiée.
Cavendish avait la capacité de faire une étude apparemment limitée donnant des résultats de grande envergure. Un exemple est son étude de l’origine de la capacité de certains poissons à donner un choc électrique. Il a composé des imitations de poisson en cuir et bois trempés dans de l’eau salée, avec des attaches en étain (étain) représentant les organes du poisson qui produisait l’effet. En utilisant des bocaux Leyden (bocaux en verre isolés avec du papier d’aluminium) pour charger les organes d’imitation, il a pu montrer que les résultats étaient tout à fait compatibles avec la capacité du poisson à produire de l’électricité. Cette enquête a été parmi les premières dans lesquelles la conductivité des solutions aqueuses (dans l’eau) a été étudiée. Cavendish a commencé à étudier la chaleur avec son père, puis est revenu sur le sujet en 1773-1776 avec une étude des instruments météorologiques de la Royal Society. (La Royal Society est l’organisation scientifique la plus ancienne et la plus distinguée au monde.) Au cours de ces études, il a élaboré les corrections les plus importantes à utiliser dans la thermométrie précise (la mesure de la température). En 1783, il publie une étude sur les moyens de déterminer le point de congélation du mercure. Il y a beaucoup ajouté à la théorie générale de la fusion (fusion ensemble par la chaleur) et de la congélation et des changements de chaleur latente qui les accompagnent (la quantité de chaleur absorbée par le matériau fondu).
Cavendish a commencé à étudier la chaleur avec son père, puis est revenu sur le sujet en 1773-1776 avec une étude des instruments météorologiques de la Royal Society. (La Royal Society est l’organisation scientifique la plus ancienne et la plus distinguée au monde.) Au cours de ces études, il a élaboré les corrections les plus importantes à utiliser dans la thermométrie précise (la mesure de la température). En 1783, il publie une étude sur les moyens de déterminer le point de congélation du mercure. Il y a beaucoup ajouté à la théorie générale de la fusion (fusion ensemble par la chaleur) et de la congélation et des changements de chaleur latente qui les accompagnent (la quantité de chaleur absorbée par le matériau fondu). L’enquête la plus célèbre de Cavendish était celle sur la densité de la terre. Il a participé à un programme de mesure de la longueur d’un pendule des secondes près d’une grande montagne (Schiehallion). Des variations par rapport à l’époque de la plaine montreraient l’attraction exercée par la montagne, à partir de laquelle on pourrait déduire la densité de sa substance. Cavendish a également abordé le sujet d’une manière plus fondamentale en déterminant la force d’attraction d’une boule de plomb très grosse et lourde pour une très petite boule légère. Le rapport entre cette force et le poids de la boule légère donnerait la densité de la terre. Ses résultats sont restés incontestés pendant près d’un siècle.
L’enquête la plus célèbre de Cavendish était celle sur la densité de la terre. Il a participé à un programme de mesure de la longueur d’un pendule des secondes près d’une grande montagne (Schiehallion). Des variations par rapport à l’époque de la plaine montreraient l’attraction exercée par la montagne, à partir de laquelle on pourrait déduire la densité de sa substance. Cavendish a également abordé le sujet d’une manière plus fondamentale en déterminant la force d’attraction d’une boule de plomb très grosse et lourde pour une très petite boule légère. Le rapport entre cette force et le poids de la boule légère donnerait la densité de la terre. Ses résultats sont restés incontestés pendant près d’un siècle.
Œuvres inédites : Si Cavendish avait publié tout son travail, son influence déjà grande aurait sans aucun doute été plus grande. En fait, il a laissé sous forme manuscrite une grande quantité de travail qui a souvent anticipé le travail de ceux qui l’ont suivi. Il n’est apparu que peu à peu jusqu’à l’étude approfondie entreprise par James Maxwell (1831-1879) et par Edward Thorpe (1845-1925). Dans ces notes se trouvent des éléments tels que le détail de ses expériences pour examiner la conductivité des métaux, ainsi que de nombreuses questions chimiques telles qu’une théorie des équivalents chimiques. Il avait même une théorie des pressions partielles avant John Dalton (1766-1844). Cependant, l’histoire des sciences regorge d’exemples de travaux non publiés qui auraient pu en influencer d’autres, mais qui ne l’ont en fait pas fait. Quoi qu’il n’ait pas révélé, Cavendish en a donné suffisamment aux autres scientifiques pour les aider sur la voie des idées modernes. Rien de ce qu’il a fait n’a été rejeté, et pour cette raison, il fait toujours partie, d’une manière unique, de la vie moderne.
Composition de l’air et de l’hydrogène : À l’époque, personne n’avait pensé à deux fois au fait que l’air était composé de différents types de gaz. À l’aide d’un ballon météo, Cavendish a prélevé des échantillons d’air de différentes couches de l’atmosphère et les a mesurés. Il pourrait expliquer la composition en pourcentage de l’air, ou la masse de chaque « ingrédient » en pourcentage d’une matière. Bien qu’il n’ait pas de noms similaires à ceux que nous avons aujourd’hui, il a découvert que l’air était composé de 79,167% d’ air phlogistiqué , ou d’azote et d’argon, et de 20,833% d’air déphlogistiqué , ou d’oxygène. Cavendish a construit des instruments qui collectent différents types de gaz au cours de ses expériences. Un gaz qui l’intéressait beaucoup était l’hydrogène . À l’aide d’un de ses instruments, il a séparé et recueilli l’hydrogène. Il a découvert que l’hydrogène était inflammable et était totalement différent de l’air dans le fait qu’il était beaucoup plus léger. À partir de là, il avait calculé différentes densités d’hydrogène.
Électricité et eau : L’électricité et l’eau ne devraient jamais être mélangées dans une expérience, mais Henry Cavendish a utilisé ces deux choses pour découvrir beaucoup de choses sur la physique et la chimie. L’une des choses qu’il a découvertes avec l’électricité était la capacité ou la capacité d’un élément à stocker de l’électricité. S’utilisant lui-même dans le cadre de l’expérience, il s’est choqué avec différentes amplitudes d’électricité et a enregistré sa douleur pour comprendre la capacité. Avec des solutions aqueuses, il a essayé de comprendre la loi d’Ohm et comment certains éléments conduisent ou traitent l’électricité mieux que d’autres.
Chronologie : Henry Cavendish en 21 dates
10 oct.1731 Henry Cavendish, 2è fils de Charles Cavendish, duc de Devonshire, et d’Anne Grey, fille du duc de Kent, naît à Nice
1749 Henry Cavendish entre au Peterhouse College de Cambridge.
1753 Henry Cavendish finit ses études, sans diplôme particulier.
1760 Cavendish est élu membre de la Royal Society.
1765 Cavendish isole « l’air inflammable » [hydrogène].
1766 Cavendish présente à la Royal Society un mémoire sur l’existence de gaz différents de l’air comme le dihydrogène (inflammable et léger) ou le gaz carbonique.
1 jan 1771 Cavendish publie l’article « An Attempt to Explain Some of the Principal Phaenomena of Electricity… » où il introduit les notions de potentiel et de charge électrique. 1773 Henry Cavendish hérite d’un oncle une immense fortune.
1773 Henry Cavendish hérite d’un oncle une immense fortune.
1776 Henry Cavendish fabrique une bouteille de Leyde en forme de torpille artificielle pour montrer que les chocs de la raie torpille sont de nature électrique.
1783 Henry Cavendish fait une analyse de l’air plus précise que celle de Lavoisier.
1783 juin 24 Lavoisier, dans son laboratoire de l’Arsenal, à Paris, combine dans une cloche de l’air déphlogistiqué et de l’air inflammable tiré du fer par l’acide vitriolique. L’opération produit de l’eau pure. Il en conclut que l’eau est composée d’air inflammable (hydrogène) et d’air vital (oxygène)
Nov. 1783 Michell écrit qu’une étoile massive aurait un tel champ gravitationnel que la lumière ne pourrait s’en échapper et nomme cela une « étoile sombre »
1784 Henry Cavendish réalise la synthèse de l’eau à partir du dioxygène et du dihydrogène.
1785 Henry Cavendish combinent l’azote et l’oxygène en faisant passer à travers un mélange de ces gaz des étincelles électriques.
1785 Henry Cavendish suspecte l’existence de l’argon.
1792 Michell développe un instrument de mesure pour mettre en évidence l’attraction de petites quantités de matières.
1797 Wollaston remet la balance de torsion de Michell à Cavendish.
1798 Cavendish publie un mémoire où il explique comment il a mesuré, au moyen de sa balance de torsion, la constante de gravitation de Newton et comment il en a déduit la densité moyenne de la Terre. 21 juin 1798 Cavendish lit son mémoire « Experiments to determine the Density of the Earth » devant la Royal Society.
21 juin 1798 Cavendish lit son mémoire « Experiments to determine the Density of the Earth » devant la Royal Society.
16 fév. 1801 Davy est officiellement interrogé par le Comité de la RI (Banks, Thompson et Cavendish), à Londres.
24 fév. 1810 Henry Cavendish, physicien et chimiste, meurt à Londres
Henry Cavendish (1731-1810) Chimiste et physicien anglais qui a mené des expériences aux intérêts divers dans son laboratoire privé. Plus particulièrement, il a déterminé la masse et la densité de la Terre. Il a étudié les propriétés de l’hydrogène et du dioxyde de carbone, notamment en comparant leur densité à celle de l’air. Cavendish a également montré que l’eau était un composé et a mesuré la chaleur spécifique de diverses substances.
Chimiste et physicien anglais qui a mené des expériences aux intérêts divers dans son laboratoire privé. Plus particulièrement, il a déterminé la masse et la densité de la Terre. Il a étudié les propriétés de l’hydrogène et du dioxyde de carbone, notamment en comparant leur densité à celle de l’air. Cavendish a également montré que l’eau était un composé et a mesuré la chaleur spécifique de diverses substances.  Ses manuscrits (publiés en 1879) ont révélé des découvertes qu’il a faites en électrostatique avant Coulomb, Ohm et Faraday – notamment en déduisant la loi du carré inverse de l’attraction et de la répulsion électrostatique. Il a également trouvé une capacité inductive spécifique. Son nom de famille est attaché au laboratoire Cavendish (fondé en 1871, financé par un membre de la famille plus tard) de l’Université de Cambridge.
Ses manuscrits (publiés en 1879) ont révélé des découvertes qu’il a faites en électrostatique avant Coulomb, Ohm et Faraday – notamment en déduisant la loi du carré inverse de l’attraction et de la répulsion électrostatique. Il a également trouvé une capacité inductive spécifique. Son nom de famille est attaché au laboratoire Cavendish (fondé en 1871, financé par un membre de la famille plus tard) de l’Université de Cambridge. 
https://fr.prospekt.estate/5561-henry-cavendish-and-the-revolutionary-discovery-of-hy.html
https://www.universalis.fr/encyclopedie/decouverte-de-l-hydrogene-par-cavendish/
https://www.kronobase.org/chronologie-categorie-Henry+Cavendish.html
http://s.bourdreux.free.fr/cabinet_Sigaud/chronologie/cavendish.htm
