

 Avec le chimiste Peter Waage, il a développé la loi d’action de masse de Guldberg et Waage, qui serait d’une grande importance pour le développement ultérieur de la chimie physique.
Avec le chimiste Peter Waage, il a développé la loi d’action de masse de Guldberg et Waage, qui serait d’une grande importance pour le développement ultérieur de la chimie physique. Cato M. Guldberg (1836-1902) était mathématicien et physicien. Avec le chimiste Peter Waage, il a développé la loi d’action de masse de Guldberg et Waage, qui serait d’une grande importance pour le développement ultérieur de la chimie physique.
Cato M. Guldberg (1836-1902) était mathématicien et physicien. Avec le chimiste Peter Waage, il a développé la loi d’action de masse de Guldberg et Waage, qui serait d’une grande importance pour le développement ultérieur de la chimie physique. Guldberg et Waage ont publié leurs premiers résultats en 1864, mais la loi de l’action de masse n’a été pleinement reconnue qu’en 1879, lorsqu’une présentation révisée a été publiée dans le Journal allemand für praktische Chemine. Guldberg a été l’un des premiers à utiliser les méthodes de la cinétique moléculaire et de la thermodynamique en chimie, et il a également fait des travaux novateurs en météorologie. Guldberg a été professeur de mathématiques appliquées à l’Université de Christiania à partir de 1869. De 1874 à -83, il a siégé au conseil d’administration des chemins de fer du pays, et à partir de 1876, il a été membre du conseil d’administration de Hovedbanen, le premier chemin de fer de Norvège. Guldberg a également été membre de plusieurs commissions. Il fut rédacteur en chef de la revue Norwegian Polytechnic entre 1863 et -73, et plusieurs fois président de la Société Scientifique d’Oslo. En 1877, il est nommé docteur honoris causa de l’Université d’Uppsala. Le buste de Guldberg est grand, plus grand qu’il n’était vivant. Il a une barbe pleine qui se poursuit en une couronne de cheveux à l’arrière de sa tête. Le front haut et l’expression sérieuse le font paraître sage. Le bronze foncé a obtenu des stries de vert plus clair avec l’âge.
Guldberg et Waage ont publié leurs premiers résultats en 1864, mais la loi de l’action de masse n’a été pleinement reconnue qu’en 1879, lorsqu’une présentation révisée a été publiée dans le Journal allemand für praktische Chemine. Guldberg a été l’un des premiers à utiliser les méthodes de la cinétique moléculaire et de la thermodynamique en chimie, et il a également fait des travaux novateurs en météorologie. Guldberg a été professeur de mathématiques appliquées à l’Université de Christiania à partir de 1869. De 1874 à -83, il a siégé au conseil d’administration des chemins de fer du pays, et à partir de 1876, il a été membre du conseil d’administration de Hovedbanen, le premier chemin de fer de Norvège. Guldberg a également été membre de plusieurs commissions. Il fut rédacteur en chef de la revue Norwegian Polytechnic entre 1863 et -73, et plusieurs fois président de la Société Scientifique d’Oslo. En 1877, il est nommé docteur honoris causa de l’Université d’Uppsala. Le buste de Guldberg est grand, plus grand qu’il n’était vivant. Il a une barbe pleine qui se poursuit en une couronne de cheveux à l’arrière de sa tête. Le front haut et l’expression sérieuse le font paraître sage. Le bronze foncé a obtenu des stries de vert plus clair avec l’âge.
Stinius Fredriksen (1902-1977) était un sculpteur. Ses premières œuvres des années 1920 étaient classiques, mais à partir du milieu des années 1930, il adopte un style en partie abstrait. En 1934, il réalise deux des sculptures à l’extérieur du palais de justice de Bergen, Sagesse et Justice, dans un style simplifié et dur. Il a travaillé la majeure partie de sa carrière à restaurer la cathédrale de Nidaros à Trondheim, et il a développé un style « gothique » personnel dans sa sculpture de cathédrale. Ses collègues l’appelaient en plaisantant St. Inius. Stinius Fredriksen a été président du Conseil des artistes visuels dans les années 1951-1955. Il a été nommé Officier de l’Ordre de Saint-Olav en 1969. Vue d’ensemble – Cato Maximilian Guldberg (1836—1902)
Vue d’ensemble – Cato Maximilian Guldberg (1836—1902)  Référence rapide (1836–1902)
Référence rapide (1836–1902)
Loi d’action de masse en chimie
Loi d’action de masse, loi stipulant que la vitesse de toute réaction chimique est proportionnelle au produit des masses des substances en réaction, chaque masse étant élevée à une puissance égale au coefficient qui se produit dans l’équation chimique. Cette loi a été formulée au cours de la période 1864-1879 par les scientifiques norvégiens Caton M. Guldberg et Peter Waage mais n’a plus qu’un intérêt historique. Cette loi était utile pour obtenir l’équation d’équilibre correcte pour une réaction, mais les expressions de vitesse qu’elle fournit sont maintenant connues pour ne s’appliquer qu’aux réactions élémentaires.
Cinétique chimique
La cinétique chimique, la branche de la chimie physique qui s’intéresse à la compréhension des taux de réactions chimiques. Il doit être mis en contraste avec la thermodynamique, qui traite de la direction dans laquelle un processus se produit mais en soi ne dit rien sur sa vitesse. La thermodynamique est la flèche du temps, tandis que la cinétique chimique est l’horloge du temps. La cinétique chimique concerne de nombreux aspects de la cosmologie, de la géologie, de la biologie, de l’ingénierie et même de la psychologie et a donc des implications de grande portée. Les principes de la cinétique chimique s’appliquent aussi bien aux processus purement physiques qu’aux réactions chimiques.
L’une des raisons de l’importance de la cinétique est qu’elle fournit des preuves des mécanismes des processus chimiques. En plus d’être d’un intérêt scientifique intrinsèque, la connaissance des mécanismes de réaction est d’une utilité pratique pour décider quelle est la manière la plus efficace de provoquer une réaction. De nombreux processus commerciaux peuvent avoir lieu par des chemins de réaction alternatifs, et la connaissance des mécanismes permet de choisir des conditions de réaction qui favorisent un chemin par rapport aux autres.
Une réaction chimique est, par définition, une réaction dans laquelle des substances chimiques sont transformées en d’autres substances, ce qui signifie que des liaisons chimiques sont rompues et formées de sorte qu’il y a des changements dans les positions relatives des atomes dans les molécules. En même temps, il y a des changements dans les arrangements des électrons qui forment les liaisons chimiques. Une description d’un mécanisme de réaction doit donc composer avec les mouvements et les vitesses des atomes et des électrons. Le mécanisme détaillé par lequel un processus chimique se produit est appelé chemin de réaction ou voie.
Le vaste la quantité de travaux effectués en cinétique chimique a conduit à la conclusion que certaines réactions chimiques se déroulent en une seule étape ; celles-ci sont appelées réactions élémentaires. D’autres réactions se déroulent en plusieurs étapes et sont dites par étapes, composites ou complexes. Les mesures des taux de réactions chimiques dans une gamme de conditions peuvent montrer si une réaction se déroule en une ou plusieurs étapes. Si une réaction est progressive, les mesures cinétiques fournissent des preuves du mécanisme des étapes élémentaires individuelles. Des informations sur les mécanismes de réaction sont également fournies par certaines études non cinétiques, mais on peut en savoir peu sur un mécanisme tant que sa cinétique n’a pas été étudiée. Même alors, un doute doit toujours subsister sur un mécanisme de réaction. Une enquête, cinétique ou autre, peut réfuter un mécanisme mais ne peut jamais l’établir avec une certitude absolue.
Taux de réaction 
La vitesse d’une réaction est définie en termes de vitesse avec laquelle les produits sont formés et les réactifs (les substances réactives) sont consommés. Pour les systèmes chimiques, il est habituel de traiter les concentrations de substances, qui sont définies comme la quantité de substance par unité de volume. Le débit peut alors être défini comme la concentration d’une substance consommée ou produite par unité de temps. Parfois, il est plus commode d’exprimer les taux en nombre de molécules formées ou consommées par unité de temps.
Les demi-vies
Une mesure de vitesse utile est la demi-vie d’un réactif, qui est définie comme le temps qu’il faut pour que la moitié de la quantité initiale subisse une réaction. Pour un type particulier de comportement cinétique (cinétique de premier ordre ; voir ci-dessous Quelques principes cinétiques), la demi-vie est indépendante de la quantité initiale. Un exemple courant et direct d’une demi-vie indépendante de la quantité initiale est celui des substances radioactives. L’uranium -238, par exemple, se désintègre avec une demi-vie de 4,5 milliards d’années ; d’une quantité initiale d’uranium, la moitié de cette quantité se sera désintégrée au cours de cette période. Le même comportement se retrouve dans de nombreuses réactions chimiques.
Théorie des collisions en chimie
Théorie des collisions, théorie utilisée pour prédire les taux de réactions chimiques, en particulier pour les gaz. La théorie des collisions est basée sur l’hypothèse que pour qu’une réaction se produise, il est nécessaire que les espèces qui réagissent (atomes ou molécules) se rassemblent ou entrent en collision les unes avec les autres. Cependant, toutes les collisions n’entraînent pas de changement chimique. Une collision ne sera efficace pour produire un changement chimique que si les espèces réunies possèdent une certaine valeur minimale d’énergie interne, égale à l’énergie d’activation de la réaction. De plus, les espèces en collision doivent être orientées d’une manière favorable au nécessaire réarrangement des atomes et des électrons. Ainsi, selon la théorie des collisions, la vitesse à laquelle une réaction chimique se déroule est égale à la fréquence des collisions effectives. Étant donné que les fréquences atomiques ou moléculaires des collisions ne peuvent être calculées avec une certaine précision que pour les gaz (par application de la théorie cinétique), l’application de la théorie des collisions est limitée aux réactions en phase gazeuse.
Cato Maximilian Guldberg (1836-1902)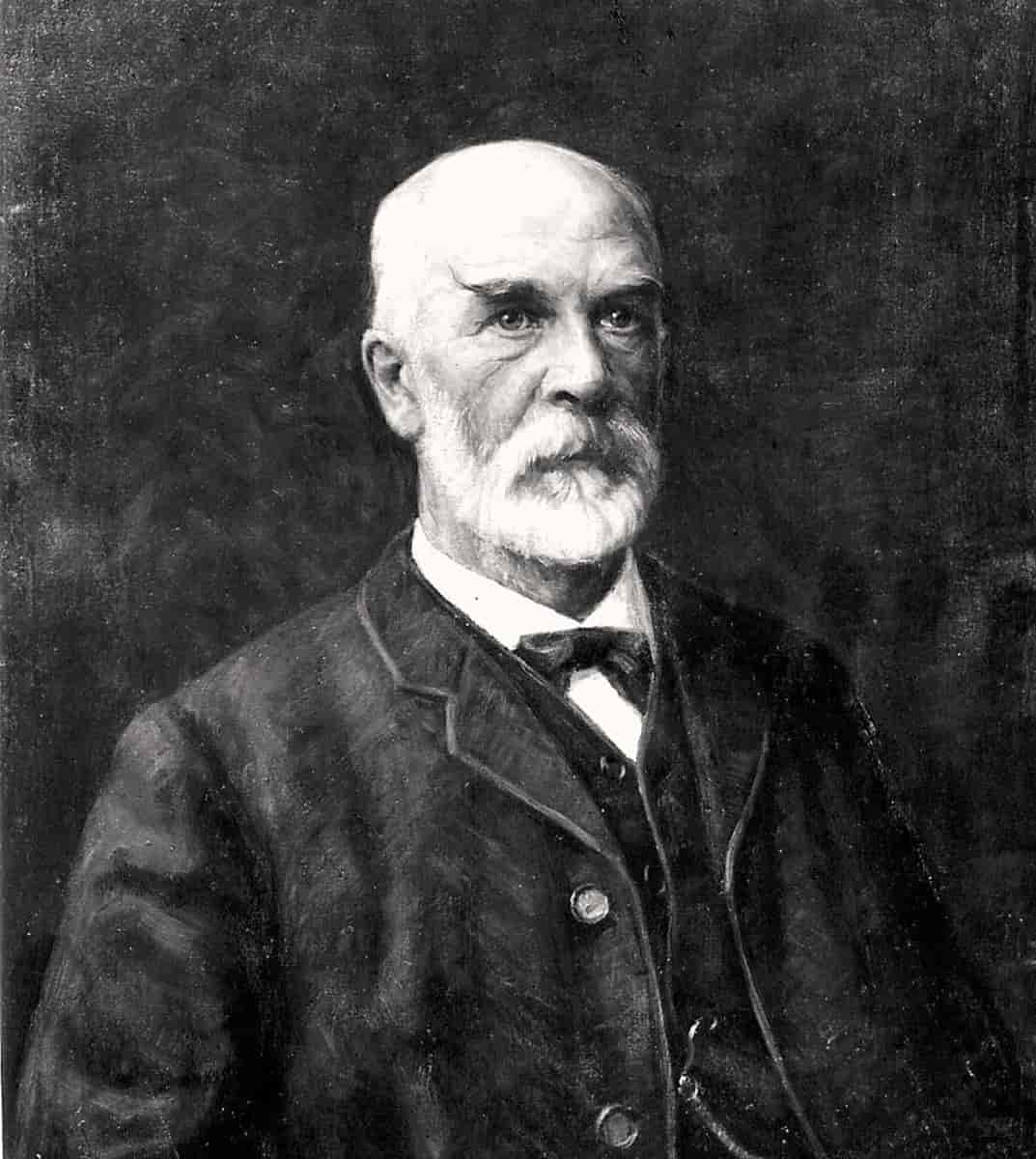
Chimiste norvégien qui, avec son beau-frère Peter Waage, a formulé la loi d’action de masse (1864), qui détaille les effets de la concentration, de la masse et de la température sur les taux de réaction chimique. La loi stipule que la vitesse d’un changement chimique dépend des concentrations des réactifs. Ainsi pour une réaction : A + B -> C la vitesse de réaction est proportionnelle à [A][B], où [A] et [B] sont des concentrations. En 1870, Guldberg a étudié la manière dont le point de congélation et la pression de vapeur d’un liquide pur sont abaissés par un composant dissous. En 1890, il a formulé la loi de Guldberg qui relie le point d’ébullition et la température critique.
https://www.youtube.com/results?search_query=Law+of+Mass+Action
https://www.oxfordreference.com/display/10.1093/oi/authority.20110803095912117
https://www.britannica.com/biography/Cato-Maximilian-Guldberg
https://www.uib.no/en/arts-and-gardens/78214/cato-m-guldberg