Qu’est-ce que la réaction de Wurtz Fittig ?
Qu’est-ce que la réaction de Wurtz Fittig ? 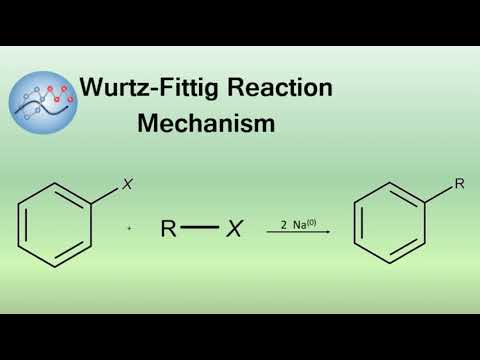 Wilhelm Rudolph Fittig (1835-19) était un chimiste allemand. Fittig était responsable de la découverte de la réaction de couplage pinacol, mésitylène, diacétyle et biphényle. Il étudie l’action du sodium sur les cétones et les hydrocarbures. Il découvre la réaction de Fittig ou réaction de Wurtz-Fittig pour la synthèse des alkyl benzènes, il propose une structure de dicétone pour la benzoquinone et isole le phénanthrène du goudron de houille. Il a découvert et synthétisé les premières lactones et étudié les structures de pipérine naphtalène et fluorène.
Wilhelm Rudolph Fittig (1835-19) était un chimiste allemand. Fittig était responsable de la découverte de la réaction de couplage pinacol, mésitylène, diacétyle et biphényle. Il étudie l’action du sodium sur les cétones et les hydrocarbures. Il découvre la réaction de Fittig ou réaction de Wurtz-Fittig pour la synthèse des alkyl benzènes, il propose une structure de dicétone pour la benzoquinone et isole le phénanthrène du goudron de houille. Il a découvert et synthétisé les premières lactones et étudié les structures de pipérine naphtalène et fluorène.:max_bytes(150000):strip_icc()/AA038816-56a12f4d3df78cf7726839fd.jpg) Carrière
Carrière
Fittig a étudié la chimie à Göttingen, obtenant un doctorat avec une thèse sur l’acétone en 1858, sous la direction d’Heinrich Limpricht et Friedrich Wöhler. Il a ensuite occupé plusieurs postes à Göttingen, étant privat douzainet (1860) et professeur extraordinaire (1870). En 1870, il obtient la chaire de Tübingen, et en 1876 celle de Strasbourg, où les laboratoires sont construits d’après ses plans. Les recherches de Fittig sont entièrement en chimie organique et couvrent un domaine exceptionnellement large. Les aldéhydes et les cétones ont fourni la matière pour ses travaux antérieurs. 

Qu’est-ce que la réaction de Wurtz Fittig ?  La réaction de Wurtz-Fittig est un mécanisme de réaction de nom organique dans lequel un halogénure d’aryle et un halogénure d’alkyle réagissent avec le sodium métallique en présence d’éther sec pour former des composés aromatiques. Le mécanisme de réaction porte le nom de Wilhelm Rudolph Fittig qui l’a découvert en prolongeant les travaux de Charles
La réaction de Wurtz-Fittig est un mécanisme de réaction de nom organique dans lequel un halogénure d’aryle et un halogénure d’alkyle réagissent avec le sodium métallique en présence d’éther sec pour former des composés aromatiques. Le mécanisme de réaction porte le nom de Wilhelm Rudolph Fittig qui l’a découvert en prolongeant les travaux de Charles
À propos de la réaction de Wurtz Fittig Le carbone est probablement le composé le plus important de tout le tableau périodique, polyvalent pour tout et constituant la base de toute science chimique. À l’aide de ce composé tétravalent et unique, la réaction de Wurtz-Fittig a été découverte. En l’an 1855, Charles Adolphe Wurtz a trouvé la réaction appelée la réaction de Wurtz. La réaction implique un nouveau carbone-carbone suivi d’une réaction de couplage entre deux halogénures d’alkyle. Cela a été étendu par un autre scientifique, Wilhelm Rudolph Fitting, en 1860. Par conséquent, la réaction est plus tard connue sous le nom de réaction de Wurtz-Fittig. Au lieu de coupler deux alkyles, Fitting a couplé un halogénure d’alkyle avec un halogénure d’aryle. La réaction fonctionne mieux pour les produits asymétriques. C’est l’une des réactions importantes de la chimie organique qui est utilisée pour synthétiser les liaisons carbone-carbone.
Le carbone est probablement le composé le plus important de tout le tableau périodique, polyvalent pour tout et constituant la base de toute science chimique. À l’aide de ce composé tétravalent et unique, la réaction de Wurtz-Fittig a été découverte. En l’an 1855, Charles Adolphe Wurtz a trouvé la réaction appelée la réaction de Wurtz. La réaction implique un nouveau carbone-carbone suivi d’une réaction de couplage entre deux halogénures d’alkyle. Cela a été étendu par un autre scientifique, Wilhelm Rudolph Fitting, en 1860. Par conséquent, la réaction est plus tard connue sous le nom de réaction de Wurtz-Fittig. Au lieu de coupler deux alkyles, Fitting a couplé un halogénure d’alkyle avec un halogénure d’aryle. La réaction fonctionne mieux pour les produits asymétriques. C’est l’une des réactions importantes de la chimie organique qui est utilisée pour synthétiser les liaisons carbone-carbone.
Discutons-en plus en détail. L’halogénure d’aryle réagit avec l’halogénure d’alkyle avec le sodium métallique en présence d’éther sec pour former du benzène à substitution alkyle. Dans cette réaction, de l’éthane et du biphényle sont également formés en petites quantités. Qu’est-ce que la réaction de Wurtz-Fittig ? 
2R – X + 2Na → R – R + 2NaX
Où R = groupe alkyle et X = ion halogénure
La réaction de Wurtz – Fittig est la meilleure pour la formation de produits asymétriques si les réactifs halogénures sont différents dans leurs réactivités chimiques relatives. La réaction est essentiellement utilisée pour l’alkylation d’halogénures d’aryle, mais elle peut être utilisée pour la production de composés diphényles à l’aide d’ultrasons.
Réaction d’ajustement
Wurtz-Fittig réagit de deux manières différentes. Le premier est celui qui est décrit ci-dessus et l’autre peut être défini comme indiqué ci-dessous : Lorsque deux molécules d’halogénure d’aryle réagissent avec le sodium métallique en présence d’éther sec pour former du diphényle. Hormis le sodium, de nombreux autres métaux peuvent également être utilisés pour donner naissance à des produits similaires. Cela comprend le potassium, le fer, le cuivre et le lithium. Lors de l’utilisation du lithium, la réaction nécessite la présence d’ultrasons afin d’obtenir le produit.
Mécanisme de la réaction de Wurtz-Fittig
Afin de comprendre la réaction de Wurtz-Fittig, prenons un exemple. Considérez la réaction générique suivante.
Dans cette réaction, le sodium métallique réagit séparément avec deux types d’halogénure pour former de l’aryl sodium et de l’alkyl sodium.
L’halogénure d’alkyle le plus réactif forme d’abord un organo-sodique, qui réagit comme un nucléophile avec un halogénure d’aryle.
Le mécanisme de la réaction de Wurtz-Fittig n’est pas certain car il existe deux approches disponibles pour décrire le mécanisme de la réaction de Wurtz-Fittig et des preuves empiriques sont disponibles pour les deux approches. Les deux approches sont énumérées ci-dessous –
- Mécanisme radical
- Mécanisme organo-alcalin
Mécanisme radical
L’approche radicale implique la formation de radical aryle et de radicaux alkyle médiés par le sodium. Selon ce mécanisme, le sodium métallique agit comme médiateur et la formation d’un radical alkyle et d’un radical aryle a lieu. Ensuite, le radical alkyle et le radical aryle se combinent pour former un composé aromatique substitué. Ce mécanisme est soutenu par la formation de sous-produits qui ne peuvent être expliqués par le mécanisme organo-alcalin. Par exemple, Bachmann et Clarke ont découvert que dans la réaction du sodium et du chlorobenzène, l’un des nombreux produits secondaires est le triphénylène dont la formation ne peut s’expliquer que par le mécanisme des radicaux libres. Le mécanisme de réaction est donné ci-dessous –
Mécanisme organo-alcalin
L’approche organo-alcaline implique la formation d’un composé organo-alcalin intermédiaire par réaction d’un halogénure d’aryle avec du sodium métallique. Selon cette approche, l’halogénure d’aryle réagit d’abord avec le sodium métallique et forme un composé organo-alcalin, puis une attaque nucléophile de l’halogénure d’alkyle a lieu. Ce mécanisme est étayé par des preuves indirectes telles que de nombreux chercheurs ont observé qu’un intermédiaire organo-alcali est en fait formé au cours de la réaction. Le mécanisme de réaction est donné ci-dessous
Utilisation d’autres métaux à la place du sodium
Les réactions de Wurtz-Fittig peuvent être réalisées en utilisant d’autres métaux tels que le cuivre, le fer, le potassium et le lithium que le sodium métallique. Lorsqu’on utilise du lithium à la place du sodium, la réaction donne un rendement appréciable, mais la réaction n’a lieu que sous ultrasons. Elle s’effectue par un mécanisme radicalaire.
Réaction de Wurtz, réaction de Fittig et réaction de Wurtz-Fittig
Généralement, les élèves confondent la réaction de Wurtz, la réaction de Fittig et la réaction de Wurtz-Fittig. Nous donnons donc ici une étude comparative de ces trois réactions sous forme de tableau –
Applications de la réaction de Wurtz-Fittig
La réaction de Wurtz – Fittig est utile en laboratoire pour la synthèse de composés organosiliciés. Par exemple, le t-butyl triméthoxysilane peut être préparé par réaction de Wurtz-Fittig. Dans ce rendement de 40% est obtenu.
Les applications des réactions de Wurtz-Fittig sont limitées. Il n’est pas utilisé à grande échelle à des fins industrielles. Cependant, il est utile dans la synthèse en laboratoire de composés aromatiques substitués.
La réaction n’a pas beaucoup d’applications. Cela est dû à la réaction secondaire, qui subit en outre un réarrangement et une élimination. C’est l’une des limitations majeures de cette réaction qui la rend inadaptée à de nombreux procédés de production.
La production d’organosilicium se fait à l’aide de cette réaction particulière bien qu’il soit assez difficile de surmonter la production en plus grande quantité. Tout était question de réaction de Wurtz-Fittig.
Rudolf Fittig (1835-1910)
Chimiste organique allemand célèbre pour ses travaux approfondis de synthèse de composés organiques à la fin du XIXe siècle. L’action du sodium sur les composés organiques découverte par Wurtz (1817-1884), a été étendue par Fittig en utilisant un mélange d’haloïde aromatique et alkylique pour produire des homologues du benzène. Fittig a préparé des pinacones (qu’il a nommés), du diphényle, du phénanthrène (1872), de la coumarone (1883), du toluène (avec Tollens en 1864) et de nombreuses autres substances. Il a séparé plusieurs composés aromatiques du goudron de houille, a étudié les réactions des acides insaturés. Fittig a proposé les structures correctes pour les quinones et (1871, avec Ira Remsen) pour l’alcaloïde pipérine qui donne à l’épice poivre noir son goût et son odeur.
https://www.chemeurope.com/en/encyclopedia/Wilhelm_Rudolph_Fittig.html