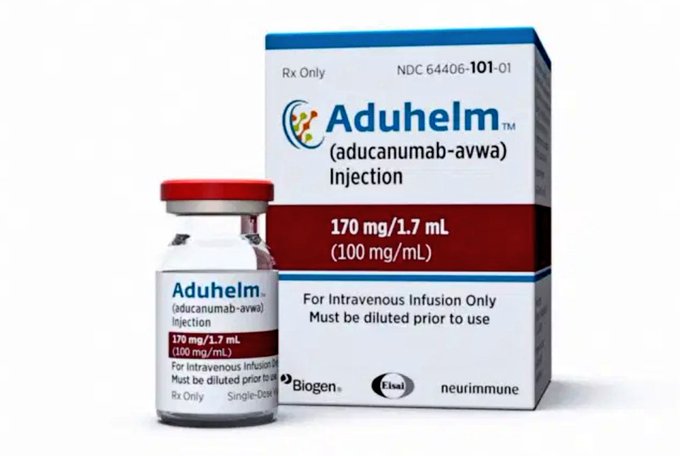
 L’approbation d’un médicament historique contre la maladie d’Alzheimer déconcerte la communauté de la recherche
L’approbation d’un médicament historique contre la maladie d’Alzheimer déconcerte la communauté de la recherche De nombreux scientifiques disent qu’il n’y a pas suffisamment de preuves que l’aducanumab de Biogen est une thérapie efficace pour la maladie.
De nombreux scientifiques disent qu’il n’y a pas suffisamment de preuves que l’aducanumab de Biogen est une thérapie efficace pour la maladie.

/GettyImages-157144420-579a41015f9b589aa9277a17.jpg) Besoin désespéré
Besoin désespéré

 « Cela va faire reculer la communauté de la recherche de 10 à 20 ans », déclare George Perry, neurobiologiste à l’Université du Texas à San Antonio et sceptique quant à l’hypothèse amyloïde.
« Cela va faire reculer la communauté de la recherche de 10 à 20 ans », déclare George Perry, neurobiologiste à l’Université du Texas à San Antonio et sceptique quant à l’hypothèse amyloïde.
«Ensemble de données problématique»  L’aducanumab, un anticorps perfusé par voie intraveineuse, est le dernier d’une longue lignée de candidats thérapeutiques visant à lutter contre les plaques amyloïdes. Bien que chaque médicament de ce type n’ait jusqu’à présent pas réussi à améliorer la cognition, des questions persistent quant à savoir si l’amyloïde-β est la bonne cible médicamenteuse, ainsi que si les chercheurs testent les candidats thérapeutiques optimaux, les bonnes doses et les patients appropriés. « Le problème avec la plupart des essais sur l’amyloïde est qu’ils n’ont rien réfuté », déclare Bart De Strooper, directeur du UK Dementia Research Institute à Londres. « Ils ont juste prouvé qu’un médicament, tel qu’il était appliqué, ne fonctionnait pas. » Les préoccupations des chercheurs se concentrent désormais sur le passage tumultueux de l’aducanumab dans les essais cliniques et sur l’ensemble de données qui en résulte, qui est incomplet et non publié.
L’aducanumab, un anticorps perfusé par voie intraveineuse, est le dernier d’une longue lignée de candidats thérapeutiques visant à lutter contre les plaques amyloïdes. Bien que chaque médicament de ce type n’ait jusqu’à présent pas réussi à améliorer la cognition, des questions persistent quant à savoir si l’amyloïde-β est la bonne cible médicamenteuse, ainsi que si les chercheurs testent les candidats thérapeutiques optimaux, les bonnes doses et les patients appropriés. « Le problème avec la plupart des essais sur l’amyloïde est qu’ils n’ont rien réfuté », déclare Bart De Strooper, directeur du UK Dementia Research Institute à Londres. « Ils ont juste prouvé qu’un médicament, tel qu’il était appliqué, ne fonctionnait pas. » Les préoccupations des chercheurs se concentrent désormais sur le passage tumultueux de l’aducanumab dans les essais cliniques et sur l’ensemble de données qui en résulte, qui est incomplet et non publié. L’approbation de la FDA est basée sur les données de deux essais de phase III. En mars 2019, les chercheurs ont jeté un coup d’œil aux données intermédiaires pendant que ces essais – qui ont été menés chez des personnes atteintes de la maladie d’Alzheimer à un stade précoce – étaient en cours. Ils ont conclu qu’il était peu probable que ceux-ci réussissent et Biogen a interrompu les deux essais plus tôt. Mais des mois plus tard, la société de biotechnologie a ramené l’anticorps du bord du gouffre, après avoir inspecté les données de plus près.
L’approbation de la FDA est basée sur les données de deux essais de phase III. En mars 2019, les chercheurs ont jeté un coup d’œil aux données intermédiaires pendant que ces essais – qui ont été menés chez des personnes atteintes de la maladie d’Alzheimer à un stade précoce – étaient en cours. Ils ont conclu qu’il était peu probable que ceux-ci réussissent et Biogen a interrompu les deux essais plus tôt. Mais des mois plus tard, la société de biotechnologie a ramené l’anticorps du bord du gouffre, après avoir inspecté les données de plus près. 
 Ces tensions ont été exposées en novembre dernier lors d’une réunion de la FDA pour discuter des données de l’essai. Un panel indépendant d’experts conseillant la FDA a évalué les données et s’est fortement opposé à l’affirmation de Biogen selon laquelle les résultats positifs partiels des essais avaient plus de poids que les résultats négatifs. Scott Emerson, biostatisticien à l’Université de Washington à Seattle, qui faisait partie du panel, a qualifié l’approche de « tirer avec un fusil de chasse sur une grange, puis peindre une cible autour des trous de balle ». Les données ont également montré que l’aducanumab a des effets secondaires non négligeables. Environ 40 % des participants traités dans les deux essais ont développé un gonflement cérébral. La plupart des gens ne présenteraient aucun symptôme lié au gonflement, mais ils auraient besoin d’examens cérébraux réguliers pour éviter des complications dangereuses – un fardeau pour les patients, les neurologues et les systèmes de santé. Lors de la réunion de novembre, 10 panélistes sur 11 ont finalement voté que les données présentées ne pouvaient pas être considérées comme une preuve de l’efficacité de l’aducanumab ; le panéliste restant était incertain. Cette semaine, la FDA est parvenue à la conclusion opposée.
Ces tensions ont été exposées en novembre dernier lors d’une réunion de la FDA pour discuter des données de l’essai. Un panel indépendant d’experts conseillant la FDA a évalué les données et s’est fortement opposé à l’affirmation de Biogen selon laquelle les résultats positifs partiels des essais avaient plus de poids que les résultats négatifs. Scott Emerson, biostatisticien à l’Université de Washington à Seattle, qui faisait partie du panel, a qualifié l’approche de « tirer avec un fusil de chasse sur une grange, puis peindre une cible autour des trous de balle ». Les données ont également montré que l’aducanumab a des effets secondaires non négligeables. Environ 40 % des participants traités dans les deux essais ont développé un gonflement cérébral. La plupart des gens ne présenteraient aucun symptôme lié au gonflement, mais ils auraient besoin d’examens cérébraux réguliers pour éviter des complications dangereuses – un fardeau pour les patients, les neurologues et les systèmes de santé. Lors de la réunion de novembre, 10 panélistes sur 11 ont finalement voté que les données présentées ne pouvaient pas être considérées comme une preuve de l’efficacité de l’aducanumab ; le panéliste restant était incertain. Cette semaine, la FDA est parvenue à la conclusion opposée.
Comme condition de l’approbation de la FDA – qui reposait sur le programme « d’approbation accélérée » de l’agence – Biogen doit maintenant mener un essai « post-commercialisation » pour confirmer que le médicament peut améliorer la cognition. Il n’a pas encore publié de détails sur le moment et la manière dont ce procès aura lieu. Biogen a jusqu’à neuf ans pour terminer l’essai. Cela inquiète les observateurs de l’industrie. « L’expérience montre que s’appuyer sur une approbation accélérée pour recueillir des preuves post-approbation de haute qualité en temps opportun n’est pas nécessairement acquis », déclare Aaron Kesselheim, qui étudie la pharmaco économie à la Harvard Medical School de Boston, Massachusetts, et est membre du panel de la FDA qui parlait de l’aducanumab.  Le choix de la FDA d’accorder une approbation accélérée à l’aducanumab – après les montagnes russes d’un programme d’essais cliniques – pourrait également avoir des implications plus larges. « Cela ouvre la porte aux sociétés pharmaceutiques qui cherchent à utiliser le programme d’approbation accélérée comme moyen de mettre des médicaments sur le marché sur la base de preuves de très faible qualité ou d’une pêche de données post-hoc », déclare Kesselheim.
Le choix de la FDA d’accorder une approbation accélérée à l’aducanumab – après les montagnes russes d’un programme d’essais cliniques – pourrait également avoir des implications plus larges. « Cela ouvre la porte aux sociétés pharmaceutiques qui cherchent à utiliser le programme d’approbation accélérée comme moyen de mettre des médicaments sur le marché sur la base de preuves de très faible qualité ou d’une pêche de données post-hoc », déclare Kesselheim.
Effets d’entraînement
 L’approbation est également susceptible de bouleverser le développement de futurs médicaments contre la maladie d’Alzheimer, selon les chercheurs. Avec une voie d’approbation établie, les développeurs de médicaments sont susceptibles de doubler leurs médicaments anti-amyloïdes. Les sociétés pharmaceutiques Eli Lilly, Roche et Eisai ont déjà des anticorps anti-amyloïde dans des essais de phase III. Eux aussi pourraient désormais être en mesure d’obtenir des approbations avec des preuves d’activité de réduction de l’amyloïde, quels que soient les effets des composés sur la cognition.
L’approbation est également susceptible de bouleverser le développement de futurs médicaments contre la maladie d’Alzheimer, selon les chercheurs. Avec une voie d’approbation établie, les développeurs de médicaments sont susceptibles de doubler leurs médicaments anti-amyloïdes. Les sociétés pharmaceutiques Eli Lilly, Roche et Eisai ont déjà des anticorps anti-amyloïde dans des essais de phase III. Eux aussi pourraient désormais être en mesure d’obtenir des approbations avec des preuves d’activité de réduction de l’amyloïde, quels que soient les effets des composés sur la cognition. Avant l’approbation, la communauté de la recherche avait commencé à se tourner vers d’autres cibles médicamenteuses associées à la maladie d’Alzheimer. Par exemple, plus de dix médicaments candidats actuellement en essai clinique sont conçus pour éliminer une autre protéine toxique du cerveau, appelée tau. David Knopman, neurologue à la clinique Mayo de Rochester, dans le Minnesota, espère que ces efforts et les étapes précédentes ne faibliront pas à la suite de la victoire de l’aducanumab, basée sur l’activité de réduction de l’amyloïde. « Nous devons envisager d’autres cibles », dit-il.
Avant l’approbation, la communauté de la recherche avait commencé à se tourner vers d’autres cibles médicamenteuses associées à la maladie d’Alzheimer. Par exemple, plus de dix médicaments candidats actuellement en essai clinique sont conçus pour éliminer une autre protéine toxique du cerveau, appelée tau. David Knopman, neurologue à la clinique Mayo de Rochester, dans le Minnesota, espère que ces efforts et les étapes précédentes ne faibliront pas à la suite de la victoire de l’aducanumab, basée sur l’activité de réduction de l’amyloïde. « Nous devons envisager d’autres cibles », dit-il. Le candidat-médicament de Biogen contre la maladie d’Alzheimer est battu par les conseillers de la FDA
Le candidat-médicament de Biogen contre la maladie d’Alzheimer est battu par les conseillers de la FDA
Des experts indépendants repoussent la vision optimiste des régulateurs sur les données cliniques Si la Food and Drug Administration (FDA) des États-Unis veut approuver le premier nouveau médicament pour la maladie d’Alzheimer en 17 ans, elle devra le faire contre la recommandation écrasante des experts auxquels elle s’est tournée pour obtenir des conseils sur la question. Un comité consultatif indépendant réuni par l’agence aujourd’hui pour examiner les données sur le candidat-médicament anticorps, appelé aducanumab, a conclu que même les données d’essais cliniques disponibles les plus solides ne confirment pas son efficacité. La FDA, qui devrait se prononcer sur l’aducanumab d’ici mars 2021, n’a pas à suivre les conseils de ses comités consultatifs, mais elle le fait généralement. S’il est approuvé, l’aducanumab serait le premier médicament contre la maladie d’Alzheimer prescrit pour ralentir le déclin cognitif et rapporterait probablement des dizaines de milliards de dollars de ventes à son développeur, Biogen. Cela pourrait également justifier la théorie battue selon laquelle le nettoyage du cerveau de la protéine collante appelée bêta-amyloïde peut traiter efficacement la maladie.
Si la Food and Drug Administration (FDA) des États-Unis veut approuver le premier nouveau médicament pour la maladie d’Alzheimer en 17 ans, elle devra le faire contre la recommandation écrasante des experts auxquels elle s’est tournée pour obtenir des conseils sur la question. Un comité consultatif indépendant réuni par l’agence aujourd’hui pour examiner les données sur le candidat-médicament anticorps, appelé aducanumab, a conclu que même les données d’essais cliniques disponibles les plus solides ne confirment pas son efficacité. La FDA, qui devrait se prononcer sur l’aducanumab d’ici mars 2021, n’a pas à suivre les conseils de ses comités consultatifs, mais elle le fait généralement. S’il est approuvé, l’aducanumab serait le premier médicament contre la maladie d’Alzheimer prescrit pour ralentir le déclin cognitif et rapporterait probablement des dizaines de milliards de dollars de ventes à son développeur, Biogen. Cela pourrait également justifier la théorie battue selon laquelle le nettoyage du cerveau de la protéine collante appelée bêta-amyloïde peut traiter efficacement la maladie. Au cours d’une section de commentaires publics de la réunion, les personnes atteintes de la maladie d’Alzheimer – y compris certaines qui ont participé aux études de Biogen – et leurs soignants ont fortement exhorté la FDA à approuver le médicament. Mais de nombreux chercheurs, y compris la plupart des membres du comité consultatif, n’ont pas été convaincus par les deux grands essais cliniques sur l’aducanumab, dont un seul a trouvé des preuves d’un bénéfice. Et le comité était mal à l’aise avec les interprétations optimistes des données de Biogen que la FDA a présentées aujourd’hui et dans les documents qu’elle a publiés cette semaine.
Au cours d’une section de commentaires publics de la réunion, les personnes atteintes de la maladie d’Alzheimer – y compris certaines qui ont participé aux études de Biogen – et leurs soignants ont fortement exhorté la FDA à approuver le médicament. Mais de nombreux chercheurs, y compris la plupart des membres du comité consultatif, n’ont pas été convaincus par les deux grands essais cliniques sur l’aducanumab, dont un seul a trouvé des preuves d’un bénéfice. Et le comité était mal à l’aise avec les interprétations optimistes des données de Biogen que la FDA a présentées aujourd’hui et dans les documents qu’elle a publiés cette semaine. « Le traitement de la maladie d’Alzheimer est un besoin énorme, urgent et non satisfait, mais je pense aussi que si nous approuvons quelque chose où les données ne sont pas solides, nous risquons de retarder un bon traitement », a déclaré Joel Perlmutter, neurologue à l’Université de Washington à St. Louis qui est l’un des 11 membres votants du comité, qui comprenait des médecins, des biostatisticiens, un représentant des patients et un administrateur des soins de santé. Biogen a montré que son anticorps peut se lier et éliminer une forme toxique de bêta-amyloïde. Mais deux essais cliniques internationaux identiques du médicament expérimental chez des patients atteints d’une maladie à un stade précoce, appelés études 301 et 302, ont semé la confusion et la controverse. Sur la base d’une analyse intermédiaire décevante des données des patients, Biogen a annoncé l’arrêt des deux essais en mars 2019, envoyant l’aducanumab sur la voie de nombreux autres candidats médicaments anti-amyloïdes ayant échoué.
« Le traitement de la maladie d’Alzheimer est un besoin énorme, urgent et non satisfait, mais je pense aussi que si nous approuvons quelque chose où les données ne sont pas solides, nous risquons de retarder un bon traitement », a déclaré Joel Perlmutter, neurologue à l’Université de Washington à St. Louis qui est l’un des 11 membres votants du comité, qui comprenait des médecins, des biostatisticiens, un représentant des patients et un administrateur des soins de santé. Biogen a montré que son anticorps peut se lier et éliminer une forme toxique de bêta-amyloïde. Mais deux essais cliniques internationaux identiques du médicament expérimental chez des patients atteints d’une maladie à un stade précoce, appelés études 301 et 302, ont semé la confusion et la controverse. Sur la base d’une analyse intermédiaire décevante des données des patients, Biogen a annoncé l’arrêt des deux essais en mars 2019, envoyant l’aducanumab sur la voie de nombreux autres candidats médicaments anti-amyloïdes ayant échoué.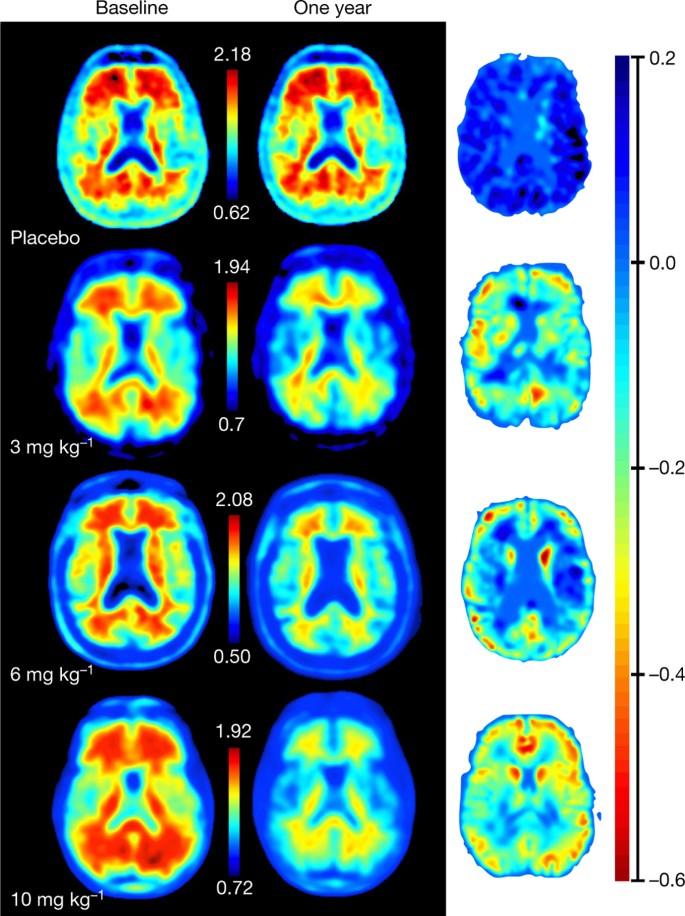 Puis, en octobre 2019, la société a choqué le domaine en annonçant qu’elle demanderait après tout l’approbation de la FDA. Les données des patients non incluses dans l’analyse précédente ont révélé qu’après 78 semaines, les participants recevant la plus élevée des deux doses d’aducanumab dans l’étude 302 présentaient un déclin cognitif inférieur de 22 % lors d’une évaluation standard de la démence que ceux d’un groupe placebo, a indiqué la société. Cependant, l’étude 301 était toujours négative : les personnes du groupe à forte dose avaient en fait un déclin légèrement pire que le groupe placebo. De nombreux chercheurs ont insisté pour que Biogen mène un autre essai pour justifier l’approbation.
Puis, en octobre 2019, la société a choqué le domaine en annonçant qu’elle demanderait après tout l’approbation de la FDA. Les données des patients non incluses dans l’analyse précédente ont révélé qu’après 78 semaines, les participants recevant la plus élevée des deux doses d’aducanumab dans l’étude 302 présentaient un déclin cognitif inférieur de 22 % lors d’une évaluation standard de la démence que ceux d’un groupe placebo, a indiqué la société. Cependant, l’étude 301 était toujours négative : les personnes du groupe à forte dose avaient en fait un déclin légèrement pire que le groupe placebo. De nombreux chercheurs ont insisté pour que Biogen mène un autre essai pour justifier l’approbation. Lors de la réunion d’aujourd’hui, des scientifiques de la FDA et de Biogen ont fait valoir que l’étude 302 – avec le soutien d’un petit essai clinique antérieur – offrait des preuves solides que l’aducanumab fonctionne. « Nous n’ignorons pas l’étude 301 », a assuré Samantha Budd Haeberlein, responsable du développement de la neuro dégénérescence chez Biogen, au comité consultatif. « Nous avons travaillé avec diligence avec la FDA, et nous comprenons suffisamment pourquoi 301 a échoué. » Elle a cité deux raisons principales. En raison des changements apportés aux schémas posologiques en milieu d’essai, plus de patients de l’étude 302 que de l’étude 301 ont reçu une dose constamment élevée du médicament. Et par rapport à 302, 301 incluaient plus de patients présentant un déclin cognitif inhabituellement rapide – 18 patients contre 13. La suppression de ces personnes de l’analyse a fait basculer le résultat dans le bras à forte dose de 301 d’un déficit de 2% à une amélioration de 6% du déclin cognitif par rapport à placebo.
Lors de la réunion d’aujourd’hui, des scientifiques de la FDA et de Biogen ont fait valoir que l’étude 302 – avec le soutien d’un petit essai clinique antérieur – offrait des preuves solides que l’aducanumab fonctionne. « Nous n’ignorons pas l’étude 301 », a assuré Samantha Budd Haeberlein, responsable du développement de la neuro dégénérescence chez Biogen, au comité consultatif. « Nous avons travaillé avec diligence avec la FDA, et nous comprenons suffisamment pourquoi 301 a échoué. » Elle a cité deux raisons principales. En raison des changements apportés aux schémas posologiques en milieu d’essai, plus de patients de l’étude 302 que de l’étude 301 ont reçu une dose constamment élevée du médicament. Et par rapport à 302, 301 incluaient plus de patients présentant un déclin cognitif inhabituellement rapide – 18 patients contre 13. La suppression de ces personnes de l’analyse a fait basculer le résultat dans le bras à forte dose de 301 d’un déficit de 2% à une amélioration de 6% du déclin cognitif par rapport à placebo. Billy Dunn, directeur du bureau des neurosciences de la FDA, a fait écho à ces explications et a déclaré que les problèmes avec 301 « ne nuisent pas de manière significative à la force de persuasion de 302″. Dans sa présentation et dans les documents de la FDA, l’agence a suggéré que le médicament pourrait encore avoir une voie claire vers l’approbation. Les membres du comité ont repoussé. Plusieurs ont cité une analyse du réviseur statistique de la FDA, Tristan Massie, qui a écrit dans un briefing publié cette semaine avant la réunion qu' »il n’y a aucune preuve substantielle convaincante de l’effet du traitement ».
Billy Dunn, directeur du bureau des neurosciences de la FDA, a fait écho à ces explications et a déclaré que les problèmes avec 301 « ne nuisent pas de manière significative à la force de persuasion de 302″. Dans sa présentation et dans les documents de la FDA, l’agence a suggéré que le médicament pourrait encore avoir une voie claire vers l’approbation. Les membres du comité ont repoussé. Plusieurs ont cité une analyse du réviseur statistique de la FDA, Tristan Massie, qui a écrit dans un briefing publié cette semaine avant la réunion qu' »il n’y a aucune preuve substantielle convaincante de l’effet du traitement ». Plusieurs panélistes ont également hésité à la première question que la FDA leur a posée : l’étude 302 fournit-elle des preuves solides de l’efficacité du médicament « sans égard à l’étude 301 » ? Université de Washington, Seattle, le statisticien Scott Emerson a noté que les deux essais devaient être évalués ensemble. « Nous ne pouvons jamais, jamais, jamais ignorer le fait que l’étude 301 a été réalisée. » « Il a été tacitement accepté [par la FDA] que 302 représentaient la vérité et 301 non », a ajouté le neurologue Michael Gold, responsable du développement des neurosciences chez AbbVie, membre sans droit de vote du comité. « Je ne comprenais tout simplement pas pourquoi il semblait y avoir ce genre d’effort unilatéral pour discréditer une étude. »
Plusieurs panélistes ont également hésité à la première question que la FDA leur a posée : l’étude 302 fournit-elle des preuves solides de l’efficacité du médicament « sans égard à l’étude 301 » ? Université de Washington, Seattle, le statisticien Scott Emerson a noté que les deux essais devaient être évalués ensemble. « Nous ne pouvons jamais, jamais, jamais ignorer le fait que l’étude 301 a été réalisée. » « Il a été tacitement accepté [par la FDA] que 302 représentaient la vérité et 301 non », a ajouté le neurologue Michael Gold, responsable du développement des neurosciences chez AbbVie, membre sans droit de vote du comité. « Je ne comprenais tout simplement pas pourquoi il semblait y avoir ce genre d’effort unilatéral pour discréditer une étude. » Les membres du comité ont également soulevé des préoccupations au sujet du 302 lui-même. Certains craignaient qu’un effet secondaire relativement courant de l’aducanumab – un gonflement du cerveau – ait révélé aux patients et aux soignants s’ils recevaient le médicament à l’étude ou un placebo, ce qui pourrait fausser les résultats. Et Madhav Thambisetty, membre du comité et neurologue à l’Institut national américain du vieillissement, a déclaré qu’en termes pratiques, les avantages documentés dans l’étude 302 étaient « extrêmement faibles ».
Les membres du comité ont également soulevé des préoccupations au sujet du 302 lui-même. Certains craignaient qu’un effet secondaire relativement courant de l’aducanumab – un gonflement du cerveau – ait révélé aux patients et aux soignants s’ils recevaient le médicament à l’étude ou un placebo, ce qui pourrait fausser les résultats. Et Madhav Thambisetty, membre du comité et neurologue à l’Institut national américain du vieillissement, a déclaré qu’en termes pratiques, les avantages documentés dans l’étude 302 étaient « extrêmement faibles ». Sur la dernière question de l’agence, s’il était « raisonnable de considérer l’étude 302 comme preuve principale de l’efficacité de l’aducanumab pour le traitement de la maladie d’Alzheimer », 10 membres ont voté « non ». (Le neurologue de l’Université de Virginie et président du panel, Nathan Fountain, a voté « incertain ».) « C’est la bonne décision », déclare Robert Howard, psychiatre à l’University College de Londres, qui a mené des essais cliniques sur des traitements potentiels contre la maladie d’Alzheimer et n’a pas participé à la réunion. . « L’approbation de l’aducanumab serait vraiment mauvaise pour mon domaine et vraiment mauvaise pour les patients », dit-il. « Nous devons garder le pied sur l’accélérateur pour trouver un traitement qui fonctionne… avec des tailles d’effet beaucoup plus spectaculaires. »
Sur la dernière question de l’agence, s’il était « raisonnable de considérer l’étude 302 comme preuve principale de l’efficacité de l’aducanumab pour le traitement de la maladie d’Alzheimer », 10 membres ont voté « non ». (Le neurologue de l’Université de Virginie et président du panel, Nathan Fountain, a voté « incertain ».) « C’est la bonne décision », déclare Robert Howard, psychiatre à l’University College de Londres, qui a mené des essais cliniques sur des traitements potentiels contre la maladie d’Alzheimer et n’a pas participé à la réunion. . « L’approbation de l’aducanumab serait vraiment mauvaise pour mon domaine et vraiment mauvaise pour les patients », dit-il. « Nous devons garder le pied sur l’accélérateur pour trouver un traitement qui fonctionne… avec des tailles d’effet beaucoup plus spectaculaires. » Comment fonctionne le nouveau médicament contre la maladie d’Alzheimer et pourquoi la FDA est sous le feu des critiques pour l’avoir approuvé
Comment fonctionne le nouveau médicament contre la maladie d’Alzheimer et pourquoi la FDA est sous le feu des critiques pour l’avoir approuvé
Premier médicament approuvé pour la maladie en 18 ans, Aduhelm ne montre que peu d’avantages dans les essais cliniques, et les experts se demandent s’il a même la bonne cible biologique. Depuis lundi, la boîte de réception de Matthew Schrag est inondée de courriels de patients et de leurs proches se demandant s’il faut espérer un nouveau médicament contre la maladie d’Alzheimer. Appelé aducanumab, le médicament a obtenu une approbation accélérée plus tôt cette semaine par la Food and Drug Administration des États-Unis. La dernière fois que la FDA a approuvé un médicament pour cette maladie dévastatrice, c’était en 2003. Mais Schrag, neurologue au Vanderbilt University Medical Center à Nashville, est très peu susceptible de prescrire la dernière thérapie. « Nous ne savons pas si cela fonctionne », dit-il, « et les effets secondaires peuvent être très importants. » Aux États-Unis, la maladie d’Alzheimer touche plus de six millions d’adultes âgés de 65 ans ou plus. C’est la cause la plus fréquente de démence et la sixième cause de décès dans ce pays. Après le diagnostic, les patients âgés vivent en moyenne de quatre à huit ans, et tout traitement susceptible de ralentir la progression de la maladie et d’améliorer la qualité de vie est désespérément recherché par leurs proches.
Depuis lundi, la boîte de réception de Matthew Schrag est inondée de courriels de patients et de leurs proches se demandant s’il faut espérer un nouveau médicament contre la maladie d’Alzheimer. Appelé aducanumab, le médicament a obtenu une approbation accélérée plus tôt cette semaine par la Food and Drug Administration des États-Unis. La dernière fois que la FDA a approuvé un médicament pour cette maladie dévastatrice, c’était en 2003. Mais Schrag, neurologue au Vanderbilt University Medical Center à Nashville, est très peu susceptible de prescrire la dernière thérapie. « Nous ne savons pas si cela fonctionne », dit-il, « et les effets secondaires peuvent être très importants. » Aux États-Unis, la maladie d’Alzheimer touche plus de six millions d’adultes âgés de 65 ans ou plus. C’est la cause la plus fréquente de démence et la sixième cause de décès dans ce pays. Après le diagnostic, les patients âgés vivent en moyenne de quatre à huit ans, et tout traitement susceptible de ralentir la progression de la maladie et d’améliorer la qualité de vie est désespérément recherché par leurs proches.
Développé par la société biotechnologique Biogen du Massachusetts et commercialisé sous le nom de marque Aduhelm, l’aducanumab élimine la forme toxique d’une protéine appelée bêta-amyloïde. Cette protéine s’accumule dans le cerveau des patients atteints de la maladie d’Alzheimer et peut perturber la communication entre les cellules cérébrales. Certains experts pensent que l’élimination de la plaque amyloïde peut traiter la cause sous-jacente de la maladie. Dans les données d’essais cliniques évaluées par la FDA, l’aducanumab a efficacement réduit l’accumulation de protéines amyloïdes dans le cerveau et a montré des signes de déclin cognitif marginal. Cela signifie que contrairement aux traitements précédemment approuvés, le médicament pourrait ralentir la progression de la maladie plutôt que de simplement cibler les symptômes. Mais la théorie selon laquelle l’amyloïde est la clé est vigoureusement débattue, et la décision de la FDA basée sur des preuves incertaines a rapidement été critiquée.
« En fin de compte, nous avons suivi notre ligne de conduite habituelle lors de la prise de décisions réglementaires dans des situations où les données ne sont pas simples », a écrit Patrizia Cavazzoni, directrice du FDA Center for Drug Evaluation and Research, dans un communiqué de presse sur la décision. « À la suite de l’approbation d’Aduhelm par la FDA, les patients atteints de la maladie d’Alzheimer disposent d’un nouveau traitement important et essentiel pour lutter contre cette maladie. Mais Schrag et de nombreux autres scientifiques ne sont pas tout à fait convaincus du potentiel du médicament à retarder la démence. « La preuve de l’efficacité n’est tout simplement pas là », dit Schrag. « Le bénéfice clinique était à peine détectable. » Les responsables de Biogen ont refusé de commenter cet article.
La procédure d’approbation accélérée
Dans les années 1980, des scientifiques ont examiné l’ADN de patients atteints de la maladie d’Alzheimer et ont découvert des mutations dans un gène qui produit la protéine bêta-amyloïde. La protéine est importante pour le développement des cellules nerveuses parmi d’autres activités biologiques. Les mutations génétiques font que la bêta-amyloïde forme des amas anormaux appelés plaque qui s’accumulent dans le cerveau. Comme ces plaques étaient déjà considérées comme le déclencheur de la maladie d’Alzheimer, les protéines bêta-amyloïdes sont rapidement devenues le centre de la recherche et du développement de médicaments. Bien que plusieurs sociétés pharmaceutiques aient développé des composés qui réduisent les dépôts amyloïdes, elles n’ont toutes pas réussi à arrêter ou à inverser la démence. Puis, en 2015, les premières preuves d’essais cliniques sur l’aducanumab ont suggéré que l’élimination des plaques amyloïdes semblait s’accompagner d’un déclin un peu plus lent de la fonction cognitive chez certains patients atteints de la maladie d’Alzheimer.
Sur la base de cette recherche, Biogen a mis en place deux essais cliniques identiques plus importants appelés Engage et Emerge. Les 3 300 participants – des patients atteints de troubles cognitifs légers ou de démence légère due à la maladie d’Alzheimer – ont reçu soit un placebo, soit une dose faible ou élevée de perfusion intraveineuse mensuelle d’aducanumab. Les deux études ont été interrompues en mars 2019 après qu’une analyse de données intermédiaire indépendante ait indiqué que l’aducanumab était « futile ». Bien que le composé ait éliminé les dépôts amyloïdes, il n’a pas arrêté ou ralenti le déclin cognitif et a été jugé peu susceptible de bénéficier aux patients.
Cependant, la société a réanalysé les données en octobre 2019, y compris des données supplémentaires depuis le début de l’analyse des données intermédiaires jusqu’à la date à laquelle l’essai a pris fin. Cette analyse a révélé que les patients de l’essai Emerge qui prenaient de fortes doses d’aducanumab présentaient un déclin cognitif de 22 % plus lent sur 18 mois, par rapport aux patients sous placebo. Aucune baisse de ce type n’a été enregistrée chez les patients de l’étude Engage. « Il ne fait aucun doute que c’est un effet statistiquement prouvable », dit Schrag, « mais le doute est de savoir si cela a une importance clinique. » Cela signifie que le déclin cognitif légèrement moindre enregistré dans l’essai n’améliore pas nécessairement la mémoire des patients. Les détracteurs du médicament soulignent également ses effets secondaires. Environ 35 % de tous les patients sous aducanumab ont présenté un gonflement cérébral douloureux et, dans certains cas, des saignements dans le cerveau.
Néanmoins, Biogen, avec le fabricant de médicaments japonais Eisai, a demandé l’approbation de la FDA sur la base de ces résultats statistiquement favorables. En novembre dernier, un panel indépendant conseillant la FDA a rejeté le médicament, arguant qu’il n’y avait pas suffisamment de preuves pour montrer que le composé bénéficiait aux patients atteints de la maladie d’Alzheimer. Le 7 juin, défiant son propre comité consultatif, la FDA a accordé l’approbation accélérée du médicament. Selon la FDA, ce type d’approbation est « destiné à fournir un accès plus précoce à des thérapies potentiellement utiles pour les patients atteints de maladies graves où il existe un besoin non satisfait et où il existe une attente de bénéfice clinique malgré une certaine incertitude résiduelle concernant ce bénéfice ».
Créer un mauvais précédent
Biogen et Eisai ont maintenant jusqu’en 2029 pour terminer un autre essai clinique afin de confirmer les avantages du médicament pour les patients atteints de la maladie d’Alzheimer. De nombreux experts affirment qu’un troisième essai clinique, identique à Engage et Emerge, aurait été une meilleure façon de briser l’égalité. « Dans ce cas, parce que les essais précédents n’étaient pas d’accord, il aurait été relativement facile si le médicament n’avait pas été approuvé de terminer un autre essai dans deux ans », explique David Rind, spécialiste en médecine interne et médecin-chef de l’Institute for Clinical et Economic Review, qui a examiné de manière indépendante les données de l’essai clinique sur l’aducanumab. « Attendre neuf ans pour savoir si cela fonctionne n’est pas vraiment à l’avantage des patients. » En 2016, la FDA a autorisé Exondys 51 pour la dystrophie musculaire de Duchenne, une maladie génétique rare et mortelle qui affecte les muscles des enfants. La décision a été prise malgré la faiblesse des données d’efficacité et les objections de son propre comité consultatif. Les résultats d’une étude en cours visant à confirmer les avantages de l’administration d’Exondys 51, qui peut coûter plus de 700 000 $ à un patient chaque année, sont toujours en attente.
Le traitement par Aducanumab coûte près de 56 000 $ par année. Le montant que chaque patient atteint de la maladie d’Alzheimer paiera de sa poche dépendra de sa couverture d’assurance. Les scintigraphies cérébrales pour surveiller les effets secondaires et autres coûts associés ajouteront un fardeau financier aux patients. « C’est une somme d’argent énorme pour un médicament dont nous ne sommes pas sûrs qu’il fonctionne du tout pour une maladie qui touche des millions de personnes aux États-Unis », déclare Rind. De plus, à sa grande surprise, la FDA a mis le médicament à la disposition de tous les patients atteints de la maladie d’Alzheimer, bien que les essais cliniques n’aient impliqué que ceux présentant des symptômes cognitifs légers. « Les groupes de défense des patients ont probablement joué un rôle important pour convaincre la FDA que cela en vaut toujours la peine », estime Walid Fouad Gellad, interniste à Pittsburg. « Ils sont prêts à accepter l’incertitude. » L’Association Alzheimer, par exemple, faisait partie de ceux qui plaidaient pour l’approbation de la FDA.
De nombreux médecins et scientifiques envisagent maintenant des conversations difficiles avec des familles qui peuvent se sentir coupables si elles ne donnent pas ce médicament à leurs proches. Mais alors que certaines personnes sont reconnaissantes de l’approbation du médicament, d’autres trouvent cette décision troublante. « Je crains qu’il n’y ait beaucoup plus de nuances et de détails ici qu’une personne moyenne désespérée de choix ne se penchera pas », déclare Ellie McBroom, la principale soignante de sa mère de 62 ans basée dans le Kentucky, qui a été diagnostiquée atteints de la maladie d’Alzheimer en 2012. « Nous voulons soutenir les avancées et les processus scientifiques, mais précipiter des traitements coûteux qui n’ont peut-être pas de résultats prouvés au détriment de personnes très vulnérables est risqué. Les experts espèrent également que ces approbations n’étoufferont pas la recherche sur d’autres cibles médicamenteuses pour la maladie d’Alzheimer.
Marc Diamond du centre médical du sud-ouest de l’Université du Texas étudie une protéine appelée tau qui se trouve dans le cerveau et est liée à la perte cognitive. Les protéines bêta-amyloïdes peuvent déclencher l’apparition de la maladie d’Alzheimer, mais lui et de nombreux autres neurologues pensent que l’accumulation de tau peut provoquer la démence, « c’est pourquoi je pense que les études ciblant la bêta-amyloïde n’ont peut-être pas montré de bons avantages pour les gens », dit-il. Diamond développe des thérapies ciblant tau. À l’avenir, lorsque ce sera au tour de ses médicaments d’être examiné, Diamond espère que la FDA se conformera à ses normes d’approbation généralement élevées.