


 En 1963, avec ses collègues C. Ramakrishnan et V. Sasisekharan, le Dr Ramachandran a développé le graphique de Ramachandran – largement utilisé dans le domaine de la conformation des protéines pour montrer les conformations énergétiquement autorisées possibles pour tout résidu d’acide aminé dans une protéine.
En 1963, avec ses collègues C. Ramakrishnan et V. Sasisekharan, le Dr Ramachandran a développé le graphique de Ramachandran – largement utilisé dans le domaine de la conformation des protéines pour montrer les conformations énergétiquement autorisées possibles pour tout résidu d’acide aminé dans une protéine. Pour ses contributions, le Dr Ramachandran a reçu plusieurs distinctions, dont le prix Shanti Swarup Bhatnagar pour la physique en 1961, et la bourse de la Royal Society of London et le prix Ewald de l’Union internationale de cristallographie en 1999. Il est ensuite devenu a créé l’unité de biophysique moléculaire à l’Institut indien des sciences en 1970 et a également été membre fondateur du Conseil culturel mondial en 1981. J’ai pris la chimie du cristal comme un programme parascolaire… et les structures cristallines ont été sérieusement prises en considération… Je me demandais pourquoi si peu de matériaux qui formaient les éléments constitutifs des systèmes vivants étaient pleinement explorés par les techniques cristallographiques.
Pour ses contributions, le Dr Ramachandran a reçu plusieurs distinctions, dont le prix Shanti Swarup Bhatnagar pour la physique en 1961, et la bourse de la Royal Society of London et le prix Ewald de l’Union internationale de cristallographie en 1999. Il est ensuite devenu a créé l’unité de biophysique moléculaire à l’Institut indien des sciences en 1970 et a également été membre fondateur du Conseil culturel mondial en 1981. J’ai pris la chimie du cristal comme un programme parascolaire… et les structures cristallines ont été sérieusement prises en considération… Je me demandais pourquoi si peu de matériaux qui formaient les éléments constitutifs des systèmes vivants étaient pleinement explorés par les techniques cristallographiques.
Déchiffré la structure en triple hélice du collagène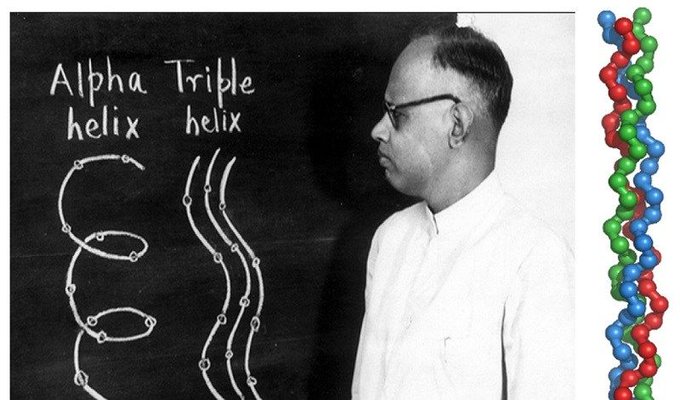
GN Ramachandran (1922-2001)


 La découverte de Raman a été l’un des outils importants qui ont détrôné le monde déterministe de la physique classique et lancé le monde probabiliste de la physique quantique. ) Sous la direction de Raman, Ramachandran a continué en physique, a fait ses recherches de troisième cycle dans les domaines de l’optique et de la topographie aux rayons X des diamants, et a obtenu un D.Sc. diplôme en 1947. Ce diplôme équivaut à un doctorat, la différence étant que l’attribution d’un doctorat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat.
La découverte de Raman a été l’un des outils importants qui ont détrôné le monde déterministe de la physique classique et lancé le monde probabiliste de la physique quantique. ) Sous la direction de Raman, Ramachandran a continué en physique, a fait ses recherches de troisième cycle dans les domaines de l’optique et de la topographie aux rayons X des diamants, et a obtenu un D.Sc. diplôme en 1947. Ce diplôme équivaut à un doctorat, la différence étant que l’attribution d’un doctorat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat. exige de soumettre une thèse sur un projet de recherche sous la direction d’un directeur qui a également suggéré le projet de thèse, alors qu’une thèse pour le D.Sc. implique principalement la soumission d’une collection d’articles décrivant le travail de recherche indépendant et original d’un candidat. En 1947, Ramachandran se rendit au Cavendish Laboratory de Cambridge, en Angleterre, alors dirigé par Sir Lawrence Bragg. À Cambridge, il a travaillé avec WA Wooster et A. Lang sur un projet cristallographique et a développé une théorie mathématique pour déterminer les constantes élastiques des cristaux à partir de mesures de réflexions diffuses des rayons X. Il a obtenu un doctorat. de l’Université de Cambridge en 1949. Pendant son séjour à Cambridge, Ramachandran a rencontré Linus Pauling et a été profondément influencé par ses conférences sur les études de modélisation des chaînes polypeptidiques.
En 1947, Ramachandran se rendit au Cavendish Laboratory de Cambridge, en Angleterre, alors dirigé par Sir Lawrence Bragg. À Cambridge, il a travaillé avec WA Wooster et A. Lang sur un projet cristallographique et a développé une théorie mathématique pour déterminer les constantes élastiques des cristaux à partir de mesures de réflexions diffuses des rayons X. Il a obtenu un doctorat. de l’Université de Cambridge en 1949. Pendant son séjour à Cambridge, Ramachandran a rencontré Linus Pauling et a été profondément influencé par ses conférences sur les études de modélisation des chaînes polypeptidiques. Ramachandran est retourné à Bangalore en 1949 et a travaillé comme professeur adjoint en physique jusqu’en 1952. À cette époque, Sir AL Mudaliar, vice-chancelier de l’Université de Madras et éducateur visionnaire, cherchait une personne appropriée pour démarrer une expérience expérimentale. division de physique à Madras et a invité Sir CV Raman à occuper ce poste. Raman a décliné l’invitation et a recommandé Ramachandran à la place. Ainsi, en 1952, Ramachandran est devenu professeur de physique à l’Université de Madras à l’âge de 29 ans. L’aide généreuse et le soutien administratif hospitalier fournis par Sir AL Mudaliar ont permis à Ramachandran de mettre en place un laboratoire de cristallographie à rayons X moderne entièrement équipé à Madras. .
Ramachandran est retourné à Bangalore en 1949 et a travaillé comme professeur adjoint en physique jusqu’en 1952. À cette époque, Sir AL Mudaliar, vice-chancelier de l’Université de Madras et éducateur visionnaire, cherchait une personne appropriée pour démarrer une expérience expérimentale. division de physique à Madras et a invité Sir CV Raman à occuper ce poste. Raman a décliné l’invitation et a recommandé Ramachandran à la place. Ainsi, en 1952, Ramachandran est devenu professeur de physique à l’Université de Madras à l’âge de 29 ans. L’aide généreuse et le soutien administratif hospitalier fournis par Sir AL Mudaliar ont permis à Ramachandran de mettre en place un laboratoire de cristallographie à rayons X moderne entièrement équipé à Madras. . Au début, Ramachandran avait du mal à décider quels projets méritaient l’attention. Les conférences de Pauling à Cambridge sur la structure des chaînes polypeptidiques étaient encore fraîches dans son esprit, tout comme les publications de Pauling sur les modèles des structures en hélice α et en feuillet β. Il savait qu’il voulait travailler sur des problèmes biologiques, mais les directions qu’il a finalement prises ont été influencées par le professeur JD Bernal qui a effectué une visite à Madras à la fin de 1952 et au début de 1953. Ramachandran a demandé à Bernal des conseils concernant des projets appropriés, et Bernal a suggéré que Ramachandran a pu travailler sur la structure du collagène pour laquelle aucun modèle satisfaisant n’avait été proposé.
Au début, Ramachandran avait du mal à décider quels projets méritaient l’attention. Les conférences de Pauling à Cambridge sur la structure des chaînes polypeptidiques étaient encore fraîches dans son esprit, tout comme les publications de Pauling sur les modèles des structures en hélice α et en feuillet β. Il savait qu’il voulait travailler sur des problèmes biologiques, mais les directions qu’il a finalement prises ont été influencées par le professeur JD Bernal qui a effectué une visite à Madras à la fin de 1952 et au début de 1953. Ramachandran a demandé à Bernal des conseils concernant des projets appropriés, et Bernal a suggéré que Ramachandran a pu travailler sur la structure du collagène pour laquelle aucun modèle satisfaisant n’avait été proposé. Ramachandran a donc porté son attention sur la résolution de la structure du collagène. En utilisant des échantillons de collagène du tendon de la queue de kangourou et avec l’aide de Gopinath Kartha qui était son premier post-doctorant, Ramachandran a produit des diagrammes de diffraction des rayons X à partir des fibres de collagène. À l’aide de ces données et armés de données physico-chimiques pertinentes, ils ont commencé à construire des modèles boule-et-bâton de la structure du collagène. Ces efforts ont abouti à un article 1 publié dans Nature en 1954 sur la structure du collagène. Leur modèle proposé pour la structure du collagène consistait en trois chaînes polypeptidiques hélicoïdales gauches parallèles se tenant côte à côte et regroupées dans un réseau hexagonal. Chaque hélice avait 3 2symétrie, donc 3 résidus par tour d’hélice. Chaque troisième résidu de chaque chaîne était une glycine, et toutes les glycines étaient situées à l’intérieur, face à l’axe central commun.
Ramachandran a donc porté son attention sur la résolution de la structure du collagène. En utilisant des échantillons de collagène du tendon de la queue de kangourou et avec l’aide de Gopinath Kartha qui était son premier post-doctorant, Ramachandran a produit des diagrammes de diffraction des rayons X à partir des fibres de collagène. À l’aide de ces données et armés de données physico-chimiques pertinentes, ils ont commencé à construire des modèles boule-et-bâton de la structure du collagène. Ces efforts ont abouti à un article 1 publié dans Nature en 1954 sur la structure du collagène. Leur modèle proposé pour la structure du collagène consistait en trois chaînes polypeptidiques hélicoïdales gauches parallèles se tenant côte à côte et regroupées dans un réseau hexagonal. Chaque hélice avait 3 2symétrie, donc 3 résidus par tour d’hélice. Chaque troisième résidu de chaque chaîne était une glycine, et toutes les glycines étaient situées à l’intérieur, face à l’axe central commun.
Par la suite, Ramachandran et Kartha ont révisé le modèle à la lumière d’études plus détaillées des modèles de diffraction des fibres. Dans le modèle révisé, le nombre de résidus par tour est devenu 3,3, de sorte que chacune des 3 chaînes hélicoïdales gauches parallèles a été amenée à s’enrouler autour de l’axe central commun de manière droite, donnant naissance à la désormais célèbre bobine enroulée. structure. Un article présentant ce modèle révisé a été publié dans Nature en 1955. Une image de Ramachandran présentant un modèle pour le collagène lors d’une conférence est illustrée à la Fig..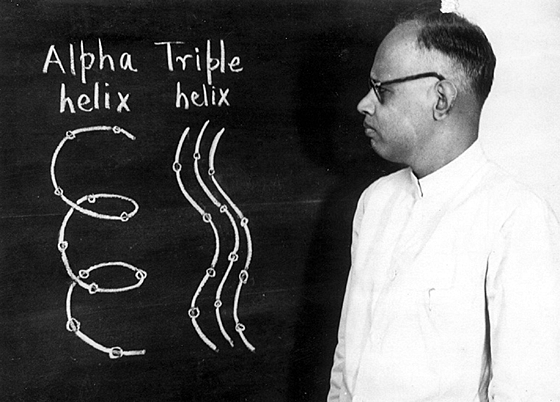 La structure proposée pour le collagène contenait deux liaisons hydrogène interchaînes. Citant des contraintes stériques, l’une de ces liaisons hydrogène a été considérée comme inacceptable par Alexander Rich et Francis Crick, qui ont proposé un modèle alternatif possédant une seule liaison hydrogène interchaîne . Ramachandran a estimé que l’apparition fréquente d’hydroxyproline dans la séquence du collagène (-Gly-Pro-Hypro-) impliquait la nécessité d’une liaison hydrogène supplémentaire, vraisemblablement via un pont d’eau entre les chaînes adjacentes. Cette controverse, quant à savoir si la structure du collagène avait une liaison hydrogène ou deux liaisons hydrogène, a fait rage pendant un certain temps, mais est maintenant résolue. Études par Helen Berman et ses collègues sur des structures monocristallines d’oligopeptides incorporant des séquences de collagène semblent indiquer qu’il existe en moyenne 1,5 liaisons hydrogène. La controverse a laissé un héritage injuste (que l’on trouve souvent dans les manuels de biochimie), qui est la tendance à discuter de la structure en triple hélice du collagène sans accorder le crédit dû à Ramachandran. Dans un récent e-mail à cet auteur, rendant hommage à Ramachandran, Pauline Harrison (Sheffield, Royaume-Uni) a écrit : « … Je pense qu’il n’a pas obtenu autant de crédit qu’il le méritait pour la structure du collagène ». On espère que les générations futures remettront les pendules à l’heure.
La structure proposée pour le collagène contenait deux liaisons hydrogène interchaînes. Citant des contraintes stériques, l’une de ces liaisons hydrogène a été considérée comme inacceptable par Alexander Rich et Francis Crick, qui ont proposé un modèle alternatif possédant une seule liaison hydrogène interchaîne . Ramachandran a estimé que l’apparition fréquente d’hydroxyproline dans la séquence du collagène (-Gly-Pro-Hypro-) impliquait la nécessité d’une liaison hydrogène supplémentaire, vraisemblablement via un pont d’eau entre les chaînes adjacentes. Cette controverse, quant à savoir si la structure du collagène avait une liaison hydrogène ou deux liaisons hydrogène, a fait rage pendant un certain temps, mais est maintenant résolue. Études par Helen Berman et ses collègues sur des structures monocristallines d’oligopeptides incorporant des séquences de collagène semblent indiquer qu’il existe en moyenne 1,5 liaisons hydrogène. La controverse a laissé un héritage injuste (que l’on trouve souvent dans les manuels de biochimie), qui est la tendance à discuter de la structure en triple hélice du collagène sans accorder le crédit dû à Ramachandran. Dans un récent e-mail à cet auteur, rendant hommage à Ramachandran, Pauline Harrison (Sheffield, Royaume-Uni) a écrit : « … Je pense qu’il n’a pas obtenu autant de crédit qu’il le méritait pour la structure du collagène ». On espère que les générations futures remettront les pendules à l’heure. La structure proposée pour le collagène contenait deux liaisons hydrogène interchaînes. Citant des contraintes stériques, l’une de ces liaisons hydrogène a été considérée comme inacceptable par Alexander Rich et Francis Crick, qui ont proposé un modèle alternatif possédant une seule liaison hydrogène interchaîne . Ramachandran a estimé que l’apparition fréquente d’hydroxyproline dans la séquence du collagène (-Gly-Pro-Hypro-) impliquait la nécessité d’une liaison hydrogène supplémentaire, vraisemblablement via un pont d’eau entre les chaînes adjacentes. Cette controverse, quant à savoir si la structure du collagène avait une liaison hydrogène ou deux liaisons hydrogène, a fait rage pendant un certain temps, mais est maintenant résolue.
La structure proposée pour le collagène contenait deux liaisons hydrogène interchaînes. Citant des contraintes stériques, l’une de ces liaisons hydrogène a été considérée comme inacceptable par Alexander Rich et Francis Crick, qui ont proposé un modèle alternatif possédant une seule liaison hydrogène interchaîne . Ramachandran a estimé que l’apparition fréquente d’hydroxyproline dans la séquence du collagène (-Gly-Pro-Hypro-) impliquait la nécessité d’une liaison hydrogène supplémentaire, vraisemblablement via un pont d’eau entre les chaînes adjacentes. Cette controverse, quant à savoir si la structure du collagène avait une liaison hydrogène ou deux liaisons hydrogène, a fait rage pendant un certain temps, mais est maintenant résolue. 

Ramchandran a appliqué ces distances limites à un autre problème – si les conformations d’une chaîne polypeptidique peuvent être restreintes parce que le squelette de la chaîne est essentiellement constitué d’unités peptidiques planes rigides. Comme deux unités peptidiques successives sont articulées à l’atome Cα, une paire d’unités peptidiques n’a que deux degrés de liberté (rotations φ et ψ) autour des liaisons reliant chaque atome Cα aux unités peptidiques voisines. Ce fut un brillant éclair de perspicacité pour Ramachandran de traiter cela comme un problème mathématique de rotation de deux plans rigides contenant des sphères dures en interaction qui doivent éviter de se heurter. En utilisant les limites de contact, si les rotations entraînent des contacts stériquement inacceptables, de telles conformations sont considérées comme non autorisées. Ce raisonnement a été la genèse du complot de Ramachandran.
 RE Dickerson a été parmi les premiers à incarner la beauté et l’importance de l’intrigue de Ramachandran dans sa monographie de 1969 intitulée La structure et l’action des protéines , qui a été écrite avec Irving Geis. Récemment, dans un e-mail adressé à cet auteur, Janet Thornton a écrit : « … Je n’ai jamais rencontré le professeur Ramachandran, mais sa contribution… se classe avec la découverte de l’hélice α par Pauling. Cela ne manque jamais de m’exciter, quand je vois l’intrigue de Ramachandran et que je réalise à quel point la beauté et l’ordre des structures protéiques sont encapsulés par cette intrigue. Je pense aussi que cette découverte majeure met en évidence l’importance d’une pensée et d’une vision claires qui ne nécessitent pas toujours des équipements coûteux et d’énormes équipes de personnes ». Personne n’aurait pu dire mieux.
RE Dickerson a été parmi les premiers à incarner la beauté et l’importance de l’intrigue de Ramachandran dans sa monographie de 1969 intitulée La structure et l’action des protéines , qui a été écrite avec Irving Geis. Récemment, dans un e-mail adressé à cet auteur, Janet Thornton a écrit : « … Je n’ai jamais rencontré le professeur Ramachandran, mais sa contribution… se classe avec la découverte de l’hélice α par Pauling. Cela ne manque jamais de m’exciter, quand je vois l’intrigue de Ramachandran et que je réalise à quel point la beauté et l’ordre des structures protéiques sont encapsulés par cette intrigue. Je pense aussi que cette découverte majeure met en évidence l’importance d’une pensée et d’une vision claires qui ne nécessitent pas toujours des équipements coûteux et d’énormes équipes de personnes ». Personne n’aurait pu dire mieux.
À la fin des années 1950 et 1960, Ramachandran a également travaillé sur plusieurs aspects de la cristallographie, tels que la détermination de phase en présence d’une dispersion anormale, la distribution de probabilité des intensités de rayons X, les statistiques cristallographiques, etc., et il a conçu la formule correcte pour calculer les angles de phase des rayons X en utilisant les différences de Bijvoet (qui se produisent lorsqu’une diffusion anormale des rayons X est présente). Il a également écrit et édité plusieurs livres et monographies traitant de la cristallographie et des conformations des biopolymères. En outre, il a organisé plusieurs conférences internationales sur la conformation des biopolymères, souvent appelées les «conférences de Madras» et auxquelles ont participé de nombreuses sommités de la biologie structurale de l’époque, dont plusieurs lauréats du prix Nobel.
Ramachandran a démissionné de Madras en 1970 et a passé un an en tant que professeur invité au département de biophysique de l’Université de Chicago. Au cours de cette visite, il a mis au point une nouvelle méthode de convolution pour reconstruire des images tridimensionnelles à partir de données bidimensionnelles, jetant ainsi les bases de la tomographie informatisée.
À son retour de Chicago, Ramachandran a rejoint l’Indian Institute of Science à Bangalore où il a fondé l’unité de biophysique moléculaire (MBU) en 1971. En 1977, il a visité le NIH à Bethesda, Maryland, États-Unis en tant que boursier Fogarty. La même année, il est élu membre de la Royal Society de Londres. Il a pris sa retraite de MBU en 1978 mais a continué comme professeur de philosophie mathématique à l’Institut jusqu’en 1989.
Au début des années 1980, Ramachandran a commencé à montrer des symptômes de la maladie de Parkinson et sa santé se détériorait. Il a pris sa retraite en 1989. Le Ramachandran malade a été pris en charge par sa femme Rajam qu’il a épousée en 1945. Cependant, en juillet 1998, Rajam est mort d’une crise cardiaque et Ramachandran ne s’est jamais complètement remis de ce coup. Le seul point culminant de cette période s’est produit en août 1999, lorsque l’Union internationale de cristallographie a décerné le 5 ePrix Ewald à Ramachandran pour ses contributions exceptionnelles au domaine de la cristallographie. Plus précisément, le prix était « dans le domaine de la diffusion anormale, … dans l’analyse de la structure des fibres, du collagène en particulier, et, avant tout, pour ses travaux fondamentaux sur la conformation macromoléculaire et la validation des structures macromoléculaires au moyen de le complot de Ramachandran ».
Depuis août 1999, il était sous soins infirmiers dans un hôpital de Madras jusqu’à sa mort suite à un arrêt cardiaque début avril 2001. Il laisse dans le deuil deux fils, Ramesh (professeur d’astrophysique à l’Université de Harvard) et Hari (Institute of Plasma Physics , Ahmedabad, Inde), et une fille, Vijaya (professeur d’informatique, Université du Texas à Austin).
Ramachandran était un homme aux multiples talents. Il s’intéressait à la musique classique indienne et occidentale, ainsi qu’aux systèmes philosophiques de l’Inde et de l’Occident. Au cours de sa brillante et illustre carrière universitaire, le nombre de prix, médailles et citations qui lui ont été décernés est trop grand pour être énuméré. En tant qu’homme qui respirait la science et en termes de ses contributions durables à la biologie structurale, Ramachandran appartenait à la même classe intellectuelle que Srinivasa Ramanujan en mathématiques et Subrahmanya Chandrasekhar en astrophysique. Pour en savoir plus sur la vie et l’époque de Ramachandran, le lecteur est renvoyé à Ramachandran – une biographie , par R. Sarma .
La mort de Ramachandran est une perte douloureuse non seulement pour les membres de sa famille mais aussi pour la communauté scientifique indienne et internationale et marque le décès d’un esprit brillant avec une grande passion pour la biologie structurale. Ses contributions scientifiques resteront comme des monuments à son superbe intellect.
Recherche scientifique


L’année suivante, Ramachandran a quitté l’Université de Madras pour rejoindre à nouveau l’IISc à Bangalore. La principale raison de sa démission était la baisse des normes de l’Université de Madras en tant qu’établissement d’enseignement. La succession de N. D. Sundaravadvelu à la place de A. L. Mudaliar en tant que vice-chancelier de l’Université de Madras avait entraîné la détérioration des normes de l’institut. À partir de 1971, Ramachandran a été impliqué dans la recherche d’algorithmes de convolution-rétroprojection dans le domaine de la tomographie aux rayons X, avec son collègue scientifique AV Lakshminarayana. Les algorithmes suggérés par Ramachandran et Lakshminarayana ont réussi à obtenir des images plus correctes numériquement et ont également permis de gagner du temps sur le traitement informatique pour la reconstruction d’image. La recherche a été publiée dans un article la même année.
Récompenses et reconnaissance
Calendrier et chronologie 1922 : GN Ramachandran est né le 8 octobre. 1942 : Devient étudiant à l’Indian Institute of Science de Bangalore. 1942 : Obtient sa maîtrise en physique de l’IISc. 1947: A terminé le diplôme de DSc, sa thèse sous la direction de Sir C V Raman. 1947 : Est allé à Cambridge pour un doctorat. 1949 : Retour de Cambridge pour devenir professeur adjoint de physique à IISc, Bangalore. 1952: Rejoint l’Université de Madras en tant que chef du département de physique. 1954 : Proposition et publication de la structure en triple hélice du collagène. 1963 : Le complot de Ramachandran est publié. 1970 : Création de l’unité de biophysique moléculaire à l’IISc, Bangalore. 1971: Quitte l’Université de Madras pour rejoindre à nouveau IISc, Bangalore. 1971: Publication d’une étude sur les algorithmes de convolution-rétroprojection en tomographie à rayons X. 1998 : Sa femme Rajalakshmi décède. 2001 : Ramachandran rend le dernier soupir le 4 juillet.
1922 : GN Ramachandran est né le 8 octobre. 1942 : Devient étudiant à l’Indian Institute of Science de Bangalore. 1942 : Obtient sa maîtrise en physique de l’IISc. 1947: A terminé le diplôme de DSc, sa thèse sous la direction de Sir C V Raman. 1947 : Est allé à Cambridge pour un doctorat. 1949 : Retour de Cambridge pour devenir professeur adjoint de physique à IISc, Bangalore. 1952: Rejoint l’Université de Madras en tant que chef du département de physique. 1954 : Proposition et publication de la structure en triple hélice du collagène. 1963 : Le complot de Ramachandran est publié. 1970 : Création de l’unité de biophysique moléculaire à l’IISc, Bangalore. 1971: Quitte l’Université de Madras pour rejoindre à nouveau IISc, Bangalore. 1971: Publication d’une étude sur les algorithmes de convolution-rétroprojection en tomographie à rayons X. 1998 : Sa femme Rajalakshmi décède. 2001 : Ramachandran rend le dernier soupir le 4 juillet.
GN Ramachandran (1922-2001) Gopalasamudram Narayanan Ramachandran était un biophysicien indien qui a découvert la structure en « bobine enroulée » en triple hélice de la molécule de collagène, entre autres contributions remarquables à la biologie structurale. Ramachandran était un maître de la cristallographie aux rayons X et, avec ses collègues, il a construit des modèles de remplissage d’espace de molécules de protéines. Il a conçu le Ramachandran Plot, une méthode pour schématiser la conformation des polypeptides, des polysaccharides et des polynucléotides. Il reste la norme internationale pour décrire les structures des protéines. Ramachandran a également exploré l’intelligence artificielle (IA), inspirée de l’ancien Syaad Nyaaya (doctrine du peut-être). Il a développé la formulation de matrice vectorielle booléenne qui a une application importante dans l’écriture de logiciels pour l’IA.
Gopalasamudram Narayanan Ramachandran était un biophysicien indien qui a découvert la structure en « bobine enroulée » en triple hélice de la molécule de collagène, entre autres contributions remarquables à la biologie structurale. Ramachandran était un maître de la cristallographie aux rayons X et, avec ses collègues, il a construit des modèles de remplissage d’espace de molécules de protéines. Il a conçu le Ramachandran Plot, une méthode pour schématiser la conformation des polypeptides, des polysaccharides et des polynucléotides. Il reste la norme internationale pour décrire les structures des protéines. Ramachandran a également exploré l’intelligence artificielle (IA), inspirée de l’ancien Syaad Nyaaya (doctrine du peut-être). Il a développé la formulation de matrice vectorielle booléenne qui a une application importante dans l’écriture de logiciels pour l’IA.
https://www.robolab.in/biography-of-g-n-ramachandran-1922-2001/
https://www.nature.com/articles/nsb0601_489
