 Grande Guerre : Fritz Haber, ce Juif qui a participé à exterminer les siens
Grande Guerre : Fritz Haber, ce Juif qui a participé à exterminer les siens Il réalise la synthèse de l’ammoniac à partir de l’azote atmosphérique, premier jalon dans la fabrication des engrais azotés et donc dans la solution du problème de la fertilisation des sols. Fritz Haber (1868-1934) Issu de la petite bourgeoisie juive prussienne. Après un doctorat de chimie organique en 1891, il embrasse la carrière académique. En 1892, il devient luthérien pour pouvoir postuler aux emplois réservés aux chrétiens dans la fonction publique. A cette période, il débute une activité féconde en chimie : il élucide la réduction du nitrobenzène dans une cellule électrochimique, explique l’équilibre quinone-hydroquinone, invente avec Max Cremer l’électrode de verre pour mesurer le pH et publie plusieurs travaux révolutionnaires pour la recherche et l’enseignement de la thermodynamique.
Il réalise la synthèse de l’ammoniac à partir de l’azote atmosphérique, premier jalon dans la fabrication des engrais azotés et donc dans la solution du problème de la fertilisation des sols. Fritz Haber (1868-1934) Issu de la petite bourgeoisie juive prussienne. Après un doctorat de chimie organique en 1891, il embrasse la carrière académique. En 1892, il devient luthérien pour pouvoir postuler aux emplois réservés aux chrétiens dans la fonction publique. A cette période, il débute une activité féconde en chimie : il élucide la réduction du nitrobenzène dans une cellule électrochimique, explique l’équilibre quinone-hydroquinone, invente avec Max Cremer l’électrode de verre pour mesurer le pH et publie plusieurs travaux révolutionnaires pour la recherche et l’enseignement de la thermodynamique.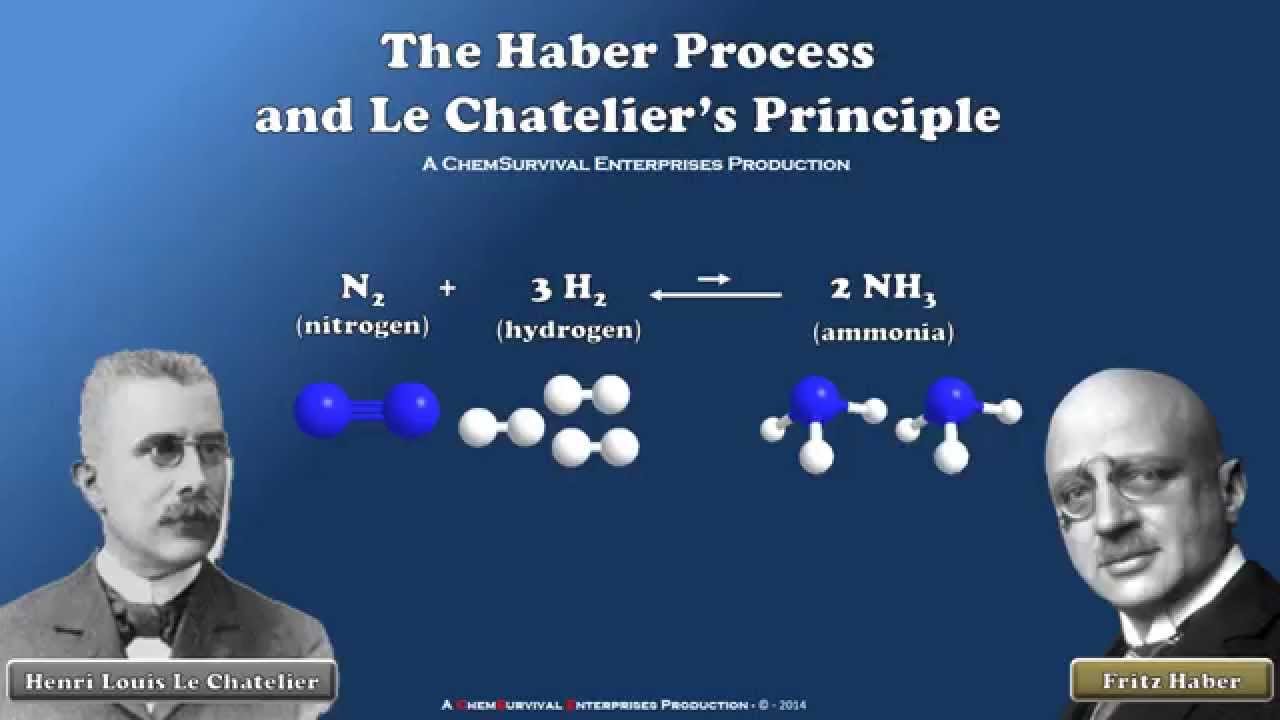 En 1904, il réalise la synthèse de l’ammoniac à partir de l’azote atmosphérique, premier jalon dans la fabrication des engrais azotés et donc dans la solution du problème de la fertilisation des sols. Son procédé qui permet actuellement de nourrir au moins deux milliards d’individus dans le monde a été amélioré par Carl Bosch (1874-1940, prix Nobel de chimie 1931) et se dénomme « procédé Haber-Bosch ». En 1911, Fritz Haber devient directeur de l’Institut Kaiser Wilhelm de Physico-chimie et d’Électrochimie. Pendant la première guerre mondiale, il coordonne la première opération de gazage à Langermarck (en avril 1915) et centralise la recherche et la production allemande d’armes chimiques. A la fin du conflit, il va être recherché comme criminel de guerre en raison de son implication personnelle dans les gazages. Comble de l’ironie, il est alors en train de se faire distinguer par le Prix Nobel de chimie relatif à l’année 1918.
En 1904, il réalise la synthèse de l’ammoniac à partir de l’azote atmosphérique, premier jalon dans la fabrication des engrais azotés et donc dans la solution du problème de la fertilisation des sols. Son procédé qui permet actuellement de nourrir au moins deux milliards d’individus dans le monde a été amélioré par Carl Bosch (1874-1940, prix Nobel de chimie 1931) et se dénomme « procédé Haber-Bosch ». En 1911, Fritz Haber devient directeur de l’Institut Kaiser Wilhelm de Physico-chimie et d’Électrochimie. Pendant la première guerre mondiale, il coordonne la première opération de gazage à Langermarck (en avril 1915) et centralise la recherche et la production allemande d’armes chimiques. A la fin du conflit, il va être recherché comme criminel de guerre en raison de son implication personnelle dans les gazages. Comble de l’ironie, il est alors en train de se faire distinguer par le Prix Nobel de chimie relatif à l’année 1918. Cependant, les Alliés cessent rapidement les poursuites et il peut donc reprendre ses activités : Haber va alors diriger le plus important centre de recherches en chimie de l’Allemagne (et probablement du monde). En prétextant de combattre les nuisibles des silos (rats et insectes), il continue à produire clandestinement des gaz vénéneux pour éviter que l’Allemagne ne soit devancée sur ce terrain par les autres puissances.
Cependant, les Alliés cessent rapidement les poursuites et il peut donc reprendre ses activités : Haber va alors diriger le plus important centre de recherches en chimie de l’Allemagne (et probablement du monde). En prétextant de combattre les nuisibles des silos (rats et insectes), il continue à produire clandestinement des gaz vénéneux pour éviter que l’Allemagne ne soit devancée sur ce terrain par les autres puissances.  C’est alors que son équipe met au point le funeste Zyklon B, employé bien après sa mort dans les camps d’extermination nazi de la Deuxième guerre mondiale. En 1933, dans le but d’« arianiser » l’administration, Hitler exige la démission des Juifs. Dans un premier temps, Haber est épargné par la mesure, mais doit renvoyer ses subordonnés juifs, qu’ils soient baptisés ou pas. Haber refuse et démissionne de ses fonctions. Il décèdera quelques mois après, le 29 janvier 1934 .
C’est alors que son équipe met au point le funeste Zyklon B, employé bien après sa mort dans les camps d’extermination nazi de la Deuxième guerre mondiale. En 1933, dans le but d’« arianiser » l’administration, Hitler exige la démission des Juifs. Dans un premier temps, Haber est épargné par la mesure, mais doit renvoyer ses subordonnés juifs, qu’ils soient baptisés ou pas. Haber refuse et démissionne de ses fonctions. Il décèdera quelques mois après, le 29 janvier 1934 .



 En Belgique, la géographie de la région d’Ypres et les vents rencontrés semblent convenir pour une première utilisation d’envergure. Promu capitaine sur ordre du Kaiser, Haber vient surveiller lui-même l’installation des réservoirs : cent soixante-dix tonnes de chlore sont enterrées sur un front de six kilomètres. Il attend que le vent soit favorable, ni trop fort ni trop faible. Le 22 avril, les robinets sont ouverts et un épais nuage verdâtre glisse lentement vers les positions britanniques et françaises. Malgré des indices fournis par des déserteurs, c’est la surprise, et, sur des hommes sans protection, les effets sont dévastateurs. Cinq mille soldats succombent et plus de quinze mille autres sont intoxiqués. Une brèche est même provoquée, elle ne sera pas exploitée. En quelques heures, l’Allemagne vient d’obtenir un résultat sans égal. Mais les mesures de protection vont vite apparaître et la réplique ne va pas tarder.
En Belgique, la géographie de la région d’Ypres et les vents rencontrés semblent convenir pour une première utilisation d’envergure. Promu capitaine sur ordre du Kaiser, Haber vient surveiller lui-même l’installation des réservoirs : cent soixante-dix tonnes de chlore sont enterrées sur un front de six kilomètres. Il attend que le vent soit favorable, ni trop fort ni trop faible. Le 22 avril, les robinets sont ouverts et un épais nuage verdâtre glisse lentement vers les positions britanniques et françaises. Malgré des indices fournis par des déserteurs, c’est la surprise, et, sur des hommes sans protection, les effets sont dévastateurs. Cinq mille soldats succombent et plus de quinze mille autres sont intoxiqués. Une brèche est même provoquée, elle ne sera pas exploitée. En quelques heures, l’Allemagne vient d’obtenir un résultat sans égal. Mais les mesures de protection vont vite apparaître et la réplique ne va pas tarder.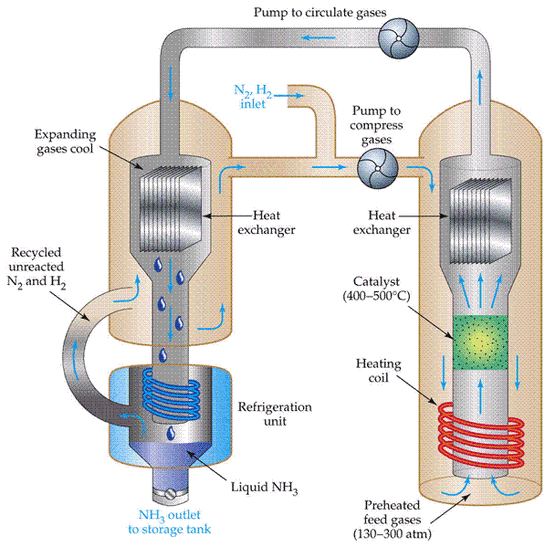 À son retour, Haber a une violente explication avec sa jeune femme Clara. Indignée, elle lui demande, au nom des principes humanitaires, d’arrêter ses recherches qu’elle juge criminelles. Il refuse. Elle se suicide quelques jours plus tard. Il lui aurait répondu : « Un savant appartient au monde en temps de paix, à son pays en temps de guerre. » Obstiné, il met au point d’autres produits toxiques efficaces et mortels, comme le phosgène et l’ypérite, puis trouve la formule (la constante de Haber) définissant la dose de gaz fatale à l’homme selon le temps d’exposition. Ce savant reçoit le prix Nobel de chimie en 1918. Après la guerre, ses recherches sur les pesticides vont permettre la mise au point de la fabrication industrielle de l’acide cyanhydrique, un acide dangereux qui entre dans la composition d’un pesticide, le Zyklon B, produit que les nazis utiliseront dans les chambres à gaz des camps d’extermination. Ce membre du conseil d’administration de l’IG Farben mourra à Bâle en 1934 après avoir dû s’exiler en raison de ses origines juives.
À son retour, Haber a une violente explication avec sa jeune femme Clara. Indignée, elle lui demande, au nom des principes humanitaires, d’arrêter ses recherches qu’elle juge criminelles. Il refuse. Elle se suicide quelques jours plus tard. Il lui aurait répondu : « Un savant appartient au monde en temps de paix, à son pays en temps de guerre. » Obstiné, il met au point d’autres produits toxiques efficaces et mortels, comme le phosgène et l’ypérite, puis trouve la formule (la constante de Haber) définissant la dose de gaz fatale à l’homme selon le temps d’exposition. Ce savant reçoit le prix Nobel de chimie en 1918. Après la guerre, ses recherches sur les pesticides vont permettre la mise au point de la fabrication industrielle de l’acide cyanhydrique, un acide dangereux qui entre dans la composition d’un pesticide, le Zyklon B, produit que les nazis utiliseront dans les chambres à gaz des camps d’extermination. Ce membre du conseil d’administration de l’IG Farben mourra à Bâle en 1934 après avoir dû s’exiler en raison de ses origines juives.
Ammoniac : qu’est-ce que c’est ? L’ammoniac est un composé de formule chimique NH3. À température ambiante, il se présente sous la forme d’un gaz incolore mais très irritant et à l’odeur piquante.
L’ammoniac est un composé de formule chimique NH3. À température ambiante, il se présente sous la forme d’un gaz incolore mais très irritant et à l’odeur piquante.
Ne pas confondre ammoniac et ammoniaque 

Dans quelles situations utiliser de l’ammoniac ou de l’ammoniaque ?  L’ammoniac sert essentiellement à la fabrication d’engrais azotés. Mais il peut également être employé comme gaz réfrigérant ou pour la production de plastiques, d’explosifs ou d’autres produits chimiques. L’ammoniaque est un excellent détachant, dégraissant et détartrant. Il entre donc dans la composition de nombreux produits ménagers.
L’ammoniac sert essentiellement à la fabrication d’engrais azotés. Mais il peut également être employé comme gaz réfrigérant ou pour la production de plastiques, d’explosifs ou d’autres produits chimiques. L’ammoniaque est un excellent détachant, dégraissant et détartrant. Il entre donc dans la composition de nombreux produits ménagers.
Produire de l’ammoniac 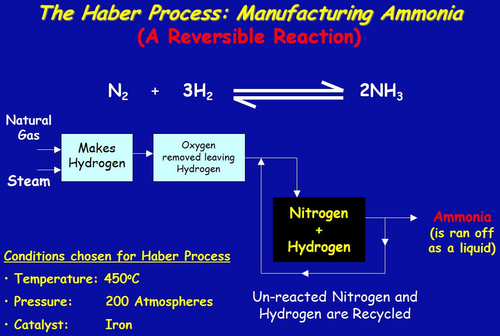
Les dangers de l’exposition à l’ammoniac L’ammoniac est très corrosif. Il peut provoquer des irritations, voire des brûlures. Une exposition à l’ammoniaque, que ce soit par inhalation, par ingestion ou par contact, peut, quant à elle, entraîner des difficultés à respirer, des brûlures dans les yeux ou le nez, l’apparition de sang dans les selles, des évanouissements, une nécrose de la peau, etc. Les deux produits doivent donc être manipuler avec la plus grande précaution.
Fritz Haber, physicien et chimiste allemand (prix Nobel de chimie 1918 pour le procédé de synthèse de l’ammoniac),
Le processus Haber
Le procédé Haber est utilisé dans la fabrication d’ammoniac à partir d’azote et d’hydrogène, puis explique les raisons des conditions utilisées dans le procédé. Le processus combine l’azote de l’air avec l’hydrogène dérivé principalement du gaz naturel (méthane) en ammoniac. La réaction est réversible et la production d’ammoniac est exothermique.
N2(g) + 3H2(g) ↽⇀ 2NH3(g) avec ΔH=−92,4kJ/mol .
Un schéma de flux pour le processus Haber ressemble à ceci  Conditions générales du processus
Conditions générales du processus
Le catalyseur : Le catalyseur est en fait un peu plus compliqué que le fer pur. Il contient de l’hydroxyde de potassium ajouté comme promoteur – une substance qui augmente son efficacité.
La pression : La pression varie d’une usine de fabrication à l’autre, mais elle est toujours élevée. Vous ne pouvez pas vous tromper dans un examen citant 200 atmosphères.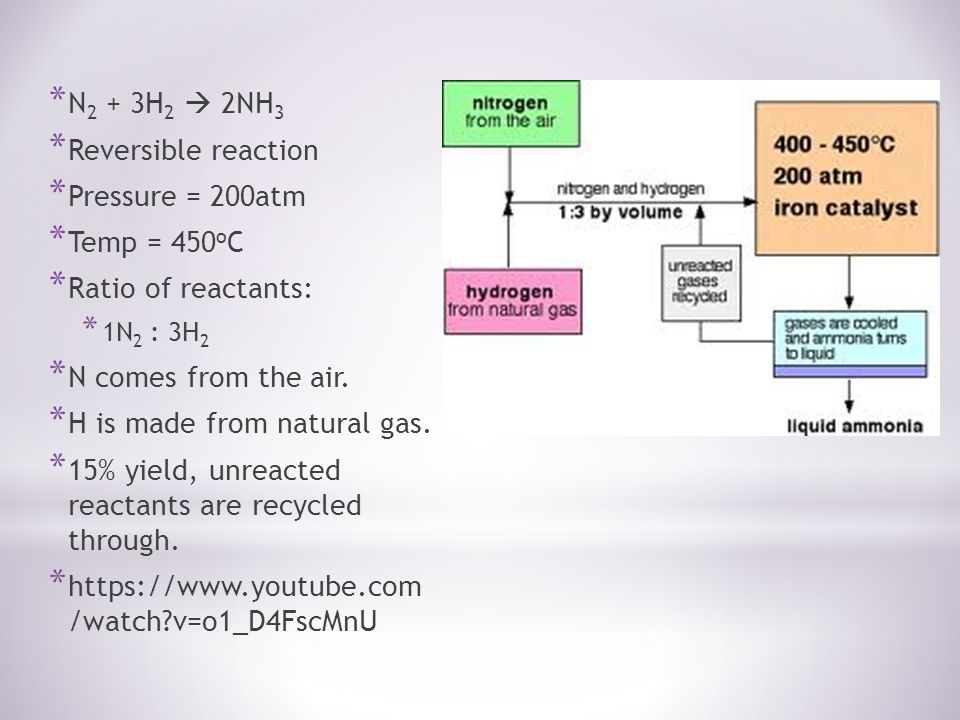 Recyclage : A chaque passage des gaz dans le réacteur, seuls 15 % environ de l’azote et de l’hydrogène se transforment en ammoniac. (Ce chiffre varie également d’une usine à l’autre.) Par recyclage continu de l’azote et de l’hydrogène n’ayant pas réagi, la conversion globale est d’environ 98 %.
Recyclage : A chaque passage des gaz dans le réacteur, seuls 15 % environ de l’azote et de l’hydrogène se transforment en ammoniac. (Ce chiffre varie également d’une usine à l’autre.) Par recyclage continu de l’azote et de l’hydrogène n’ayant pas réagi, la conversion globale est d’environ 98 %. Composition
Composition
Les proportions d’azote et d’hydrogène : Le mélange d’azote et d’hydrogène entrant dans le réacteur est dans le rapport de 1 volume d’azote pour 3 volumes d’hydrogène. La loi d’Avogadro dit que des volumes égaux de gaz à la même température et pression contiennent un nombre égal de molécules. Cela signifie que les gaz entrent dans le réacteur dans le rapport de 1 molécule d’azote pour 3 d’hydrogène. C’est la proportion demandée par l’équation. Dans certaines réactions, vous pouvez choisir d’utiliser un excès de l’un des réactifs. Vous feriez cela s’il est particulièrement important d’utiliser autant que possible l’autre réactif – si, par exemple, il était beaucoup plus cher. Cela ne s’applique pas dans ce cas. Il y a toujours un inconvénient à utiliser autre chose que les proportions de l’équation. Si vous avez un excès d’un réactif, il y aura des molécules traversant le réacteur qui ne pourront pas réagir car il n’y a rien avec quoi réagir. Cela gaspille de l’espace dans le réacteur – en particulier de l’espace à la surface du catalyseur. Température
Température
Considérations sur l’équilibre : vous devez déplacer la position de l’équilibre (équation \(\ref{eq1}\)) le plus loin possible vers la droite afin de produire la quantité maximale d’ammoniac dans le mélange à l’équilibre. La réaction directe est exothermique avec \(ΔH=-92,4 kJ/mol\). Selon le principe de Le Chatelier, cela sera favorisé si vous baissez la température. Le système répondra en déplaçant la position d’équilibre pour contrer cela – en d’autres termes en produisant plus de chaleur. Pour obtenir autant d’ammoniac que possible dans le mélange à l’équilibre, vous avez besoin d’une température aussi basse que possible. Cependant, 400 – 450°C n’est pas une basse température !1) le plus loin possible vers la droite afin de produire le maximum d’ammoniac possible dans le mélange à l’équilibre. La réaction directe est exothermique avec. Selon ∆H _= − 92,4 kJ/mol
Considérations sur la vitesse : Plus la température que vous utilisez est basse, plus la réaction est lente. Un fabricant essaie de produire autant d’ammoniac que possible par jour. Cela n’a aucun sens d’essayer d’atteindre un mélange à l’équilibre qui contient une proportion très élevée d’ammoniac s’il faut plusieurs années pour que la réaction atteigne cet équilibre. Vous avez besoin que les gaz atteignent l’équilibre dans le très court laps de temps pendant lequel ils seront en contact avec le catalyseur dans le réacteur.
Le compromis : 400 – 450°C est une température de compromis produisant une proportion raisonnablement élevée d’ammoniac dans le mélange à l’équilibre (même si elle n’est que de 15%), mais en un temps très court.
Pression
Notez qu’il y a 4 molécules sur le côté gauche de l’équation \(\ref{eq1}\), mais seulement 2 sur la droite. Selon le principe de Le Chatelier, si vous augmentez la pression, le système répondra en favorisant la réaction qui produit moins de molécules. Cela fera retomber la pression. Afin d’obtenir autant d’ammoniac que possible dans le mélange à l’équilibre, vous avez besoin d’une pression aussi élevée que possible. 200 atmosphères est une haute pression, mais pas étonnamment élevée.1
, mais seulement 2 à droite. Selon le principe de Le Chatelier, si vous augmentez la pression, le système répondra en favorisant la réaction qui produit moins de molécules. Cela fera retomber la pression. Afin d’obtenir autant d’ammoniac que possible dans le mélange à l’équilibre, vous avez besoin d’une pression aussi élevée que possible. 200 atmosphères est une haute pression, mais pas étonnamment élevée.
Considérations sur le taux : L’augmentation de la pression rapproche les molécules. Dans ce cas particulier, cela augmentera leurs chances de heurter et de coller à la surface du catalyseur où ils peuvent réagir. Plus la pression est élevée, mieux c’est en termes de vitesse de réaction gazeuse.  Considérations économiques : Les pressions très élevées sont très coûteuses à produire pour deux raisons. Vous devez construire des tuyaux et des enceintes de confinement extrêmement solides pour résister à la très haute pression. Cela augmente vos coûts d’investissement lors de la construction de l’usine. Les hautes pressions coûtent cher à produire et à entretenir. Cela signifie que les coûts de fonctionnement de votre installation sont très élevés.
Considérations économiques : Les pressions très élevées sont très coûteuses à produire pour deux raisons. Vous devez construire des tuyaux et des enceintes de confinement extrêmement solides pour résister à la très haute pression. Cela augmente vos coûts d’investissement lors de la construction de l’usine. Les hautes pressions coûtent cher à produire et à entretenir. Cela signifie que les coûts de fonctionnement de votre installation sont très élevés.
Le compromis : 200 atmosphères est une pression de compromis choisie pour des raisons économiques. Si la pression utilisée est trop élevée, le coût de sa production dépasse le prix que vous pouvez obtenir pour l’ammoniac supplémentaire produit.
Considérations d’équilibre : Le catalyseur n’a aucun effet sur la position de l’équilibre. L’ajout d’un catalyseur ne produit pas de pourcentage supérieur d’ammoniac dans le mélange à l’équilibre. Sa seule fonction est d’accélérer la réaction.
Considérations sur la vitesse : en l’absence de catalyseur, la réaction est si lente que pratiquement aucune réaction ne se produit en un temps raisonnable. Le catalyseur assure une réaction suffisamment rapide pour qu’un équilibre dynamique s’établisse dans le temps très court où les gaz sont effectivement dans le réacteur.
Séparation de l’ammoniac : A la sortie du réacteur, les gaz sont chauds et à très haute pression. L’ammoniac est facilement liquéfié sous pression tant qu’il n’est pas trop chaud, et ainsi la température du mélange est suffisamment abaissée pour que l’ammoniac se transforme en liquide. L’azote et l’hydrogène restent gazeux même sous ces hautes pressions et peuvent être recyclés.
En mélangeant une partie d’ammoniac à neuf parties d’air à l’aide d’un catalyseur, l’ammoniac sera oxydé en acide nitrique.
4NH3+ 5O2 –→4NON +6H2O
2NON+ O2→ 2NO2N
2NO2N + 2H2O→ 2HNO3+H2
Fritz Haber (1868-1934)
https://todayinsci.com/Events/Patent/Ammonia971501.htm
https://todayinsci.com/1/1_29.htm#death
https://www.futura-sciences.com/sciences/personnalites/chimie-fritz-haber-247/
https://www.futura-sciences.com/sciences/definitions/chimie-ammoniac-2959
