
 Irwin Allan Rose (16 juillet 1926 – 2 juin 2015) était un biologiste américain. Avec Aaron Ciechanover et Avram Hershko, il a reçu le prix Nobel de chimie 2004 pour la découverte de la dégradation des protéines médiée par l’ubiquitine.
Irwin Allan Rose (16 juillet 1926 – 2 juin 2015) était un biologiste américain. Avec Aaron Ciechanover et Avram Hershko, il a reçu le prix Nobel de chimie 2004 pour la découverte de la dégradation des protéines médiée par l’ubiquitine.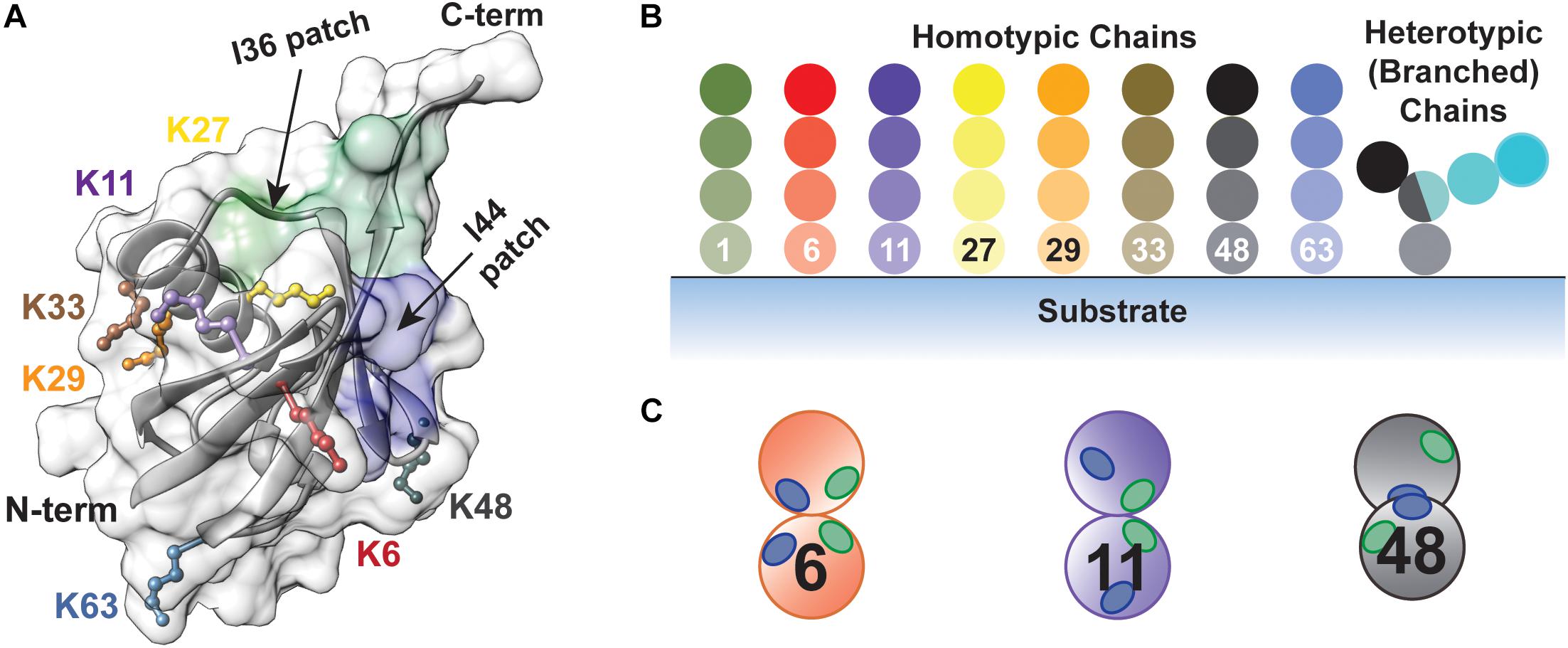 Rose a obtenu un doctorat en biochimie de l’Université de Chicago en 1952. Il a ensuite servi (1954–63) à la faculté de la faculté de médecine de l’Université de Yale et a été membre senior (1963–95) de la Fox Chase Cancer Center à Philadelphie. En 1997, il a accepté une nomination spéciale en tant que chercheur émérite à l’Université de Californie, Irvine.
Rose a obtenu un doctorat en biochimie de l’Université de Chicago en 1952. Il a ensuite servi (1954–63) à la faculté de la faculté de médecine de l’Université de Yale et a été membre senior (1963–95) de la Fox Chase Cancer Center à Philadelphie. En 1997, il a accepté une nomination spéciale en tant que chercheur émérite à l’Université de Californie, Irvine. À la fin des années 1970 et au début des années 80, Ciechanover et Hershko étaient des scientifiques invités à Fox Chase, où ils ont travaillé avec Rose sur leurs recherches récompensées par le prix Nobel. Le processus que les trois hommes ont découvert implique une série d’étapes soigneusement orchestrées par lesquelles les cellules dégradent, ou détruisent, les protéines qui ne servent plus à rien. Dans la première étape, une molécule appelée l’ubiquitine (du latin ubique, qui signifie « partout », car elle est présente dans tant de cellules et d’organismes différents) se fixe à la protéine ciblée pour la destruction et l’accompagne dans une protéasome – essentiellement un sac d’enzymes puissantes qui divisent la protéine en ses acides aminés composants. La membrane externe du protéasome n’admet que des protéines portant une molécule d’ubiquitine. La molécule d’ubiquitine se détache avant d’entrer dans le protéasome et les cellules la réutilisent pour marquer une autre protéine en vue de sa destruction.
À la fin des années 1970 et au début des années 80, Ciechanover et Hershko étaient des scientifiques invités à Fox Chase, où ils ont travaillé avec Rose sur leurs recherches récompensées par le prix Nobel. Le processus que les trois hommes ont découvert implique une série d’étapes soigneusement orchestrées par lesquelles les cellules dégradent, ou détruisent, les protéines qui ne servent plus à rien. Dans la première étape, une molécule appelée l’ubiquitine (du latin ubique, qui signifie « partout », car elle est présente dans tant de cellules et d’organismes différents) se fixe à la protéine ciblée pour la destruction et l’accompagne dans une protéasome – essentiellement un sac d’enzymes puissantes qui divisent la protéine en ses acides aminés composants. La membrane externe du protéasome n’admet que des protéines portant une molécule d’ubiquitine. La molécule d’ubiquitine se détache avant d’entrer dans le protéasome et les cellules la réutilisent pour marquer une autre protéine en vue de sa destruction.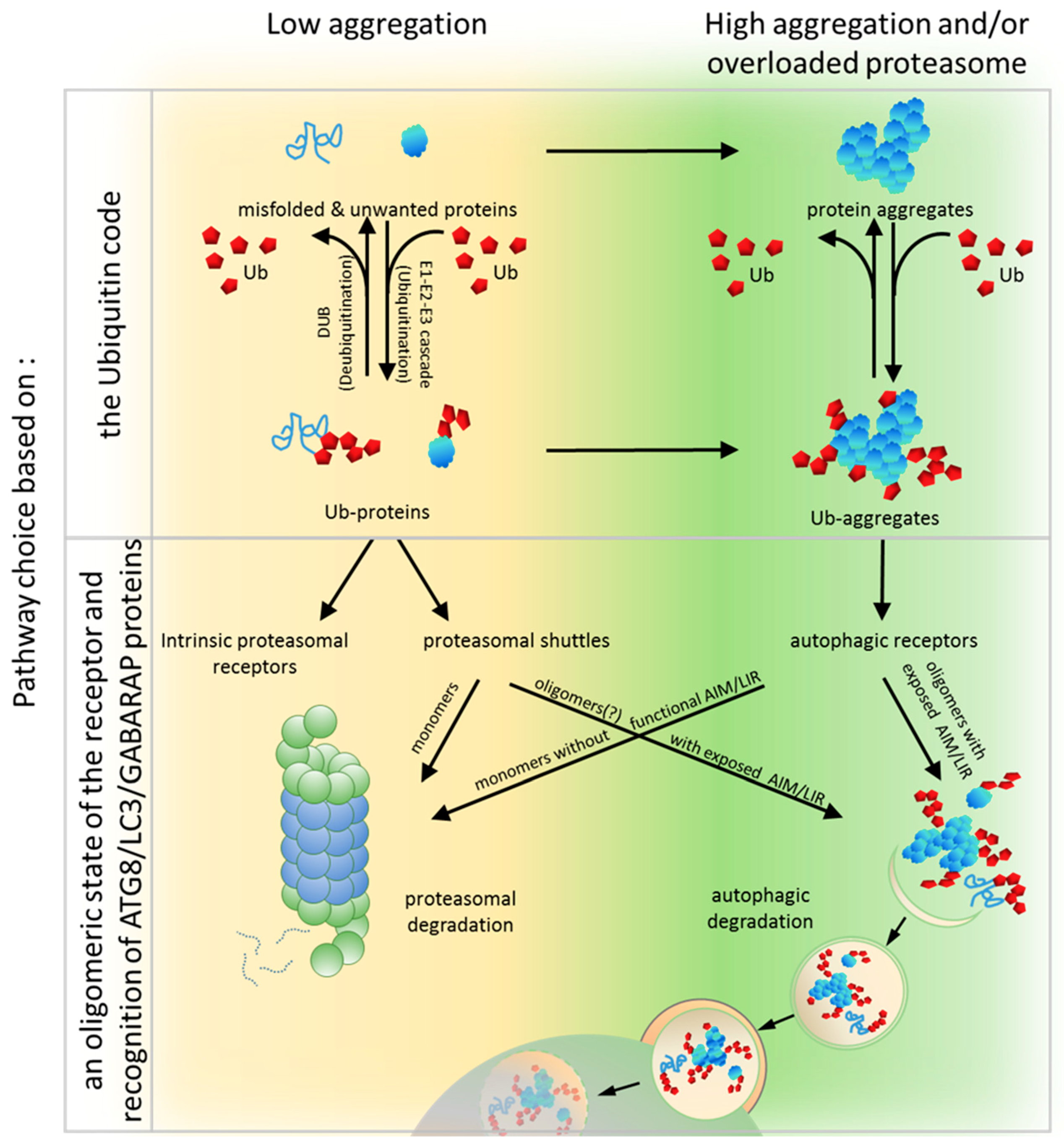 Rose, Ciechanover et Hershko ont également démontré que la médiation par l’ubiquitinela dégradation des protéines aide à contrôler un certain nombre d’autres processus biochimiques critiques, notamment la division cellulaire, la réparation des défauts de l’ADN et la transcription génique, le processus par lequel les gènes utilisent leurs instructions codées pour fabriquer une protéine. Des maladies telles que la fibrose kystique surviennent lorsque le système de dégradation des protéines ne fonctionne pas normalement. En utilisant les découvertes de Rose, Ciechanover et Hershko, les chercheurs espéraient éventuellement développer des médicaments contre de telles maladies.
Rose, Ciechanover et Hershko ont également démontré que la médiation par l’ubiquitinela dégradation des protéines aide à contrôler un certain nombre d’autres processus biochimiques critiques, notamment la division cellulaire, la réparation des défauts de l’ADN et la transcription génique, le processus par lequel les gènes utilisent leurs instructions codées pour fabriquer une protéine. Des maladies telles que la fibrose kystique surviennent lorsque le système de dégradation des protéines ne fonctionne pas normalement. En utilisant les découvertes de Rose, Ciechanover et Hershko, les chercheurs espéraient éventuellement développer des médicaments contre de telles maladies. Ubiquitine : structures, fonctions, mécanismes
Ubiquitine : structures, fonctions, mécanismes
 Le rôle du système ubiquitine/protéasome dans les réponses cellulaires aux radiations
Le rôle du système ubiquitine/protéasome dans les réponses cellulaires aux radiations
![]() L’ampleur de la modulation sera influencée par la diversité fonctionnelle et structurelle exprimée par le système. Les types de cellules varient dans les structures Ub / protéasome qu’ils possèdent et le niveau auquel ils fonctionnent, et cela change à mesure qu’ils passent de l’état normal à l’état cancéreux. Les changements fonctionnels liés au cancer au sein du système Ub/protéasome peuvent donc présenter des cibles uniques pour le traitement du cancer, en particulier lorsque les agents de ciblage sont utilisés en association avec la radio ou la chimiothérapie. Le composé peptidique d’acide boronique PS-341, qui a été conçu pour inhiber l’activité chymotryptique du protéasome, fait l’objet d’essais cliniques pour le traitement de tumeurs solides et hématogènes. Il a montré une certaine efficacité seul et en association avec la chimiothérapie. Des études précliniques ont montré que le PS-341 potentialise également les effets cytotoxiques de la radiothérapie. De plus, il a été démontré que d’autres médicaments d’usage clinique courant affectent la fonction du protéasome, et leurs activités peuvent être réexaminées de manière précieuse dans cette perspective.
L’ampleur de la modulation sera influencée par la diversité fonctionnelle et structurelle exprimée par le système. Les types de cellules varient dans les structures Ub / protéasome qu’ils possèdent et le niveau auquel ils fonctionnent, et cela change à mesure qu’ils passent de l’état normal à l’état cancéreux. Les changements fonctionnels liés au cancer au sein du système Ub/protéasome peuvent donc présenter des cibles uniques pour le traitement du cancer, en particulier lorsque les agents de ciblage sont utilisés en association avec la radio ou la chimiothérapie. Le composé peptidique d’acide boronique PS-341, qui a été conçu pour inhiber l’activité chymotryptique du protéasome, fait l’objet d’essais cliniques pour le traitement de tumeurs solides et hématogènes. Il a montré une certaine efficacité seul et en association avec la chimiothérapie. Des études précliniques ont montré que le PS-341 potentialise également les effets cytotoxiques de la radiothérapie. De plus, il a été démontré que d’autres médicaments d’usage clinique courant affectent la fonction du protéasome, et leurs activités peuvent être réexaminées de manière précieuse dans cette perspective.  La voie de dégradation ubiquitine dépendante
La voie de dégradation ubiquitine dépendante
Il existe dans la cellule un mécanisme de dégradation des protéines, utilisant de l’ATP, qui a valu à ses découvreurs le prix Nobel de chimie, en 2004. Cette voie est dite « ubiquitine-dépendante », elle permet le catabolisme de protéines ayant subi un marquage spécifique par une petite protéine (76 acides aminés), l’ubiquitine. Cette voie de dégradation est au cœur des processus biologiques, elle ne se cantonne pas à éliminer les protéines anormales ou endommagées, mais intervient dans la régulation fine des taux de protéines clés de la cellule.
Introduction – Avant-propos La voie de dégradation ubiquitine dépendante fait partie de ces systèmes essentiels de la cellule dont l’existence était totalement ignorée il y a encore quelques dizaines d’années, et dont la découverte a bouleversé une partie de nos connaissances sur le fonctionnement cellulaire (comme a pu le faire la découverte des mécanismes de régulation du cycle cellulaire). L’importance physiologique de ce système a d’ailleurs valu à ses découvreurs le prix Nobel de chimie en 2004.
La voie de dégradation ubiquitine dépendante fait partie de ces systèmes essentiels de la cellule dont l’existence était totalement ignorée il y a encore quelques dizaines d’années, et dont la découverte a bouleversé une partie de nos connaissances sur le fonctionnement cellulaire (comme a pu le faire la découverte des mécanismes de régulation du cycle cellulaire). L’importance physiologique de ce système a d’ailleurs valu à ses découvreurs le prix Nobel de chimie en 2004. De nos jours, c’est l’un des sujets de recherche les plus actifs en biologie cellulaire. De ce fait, la situation s’est considérablement complexifiée depuis la première mise en évidence de l’existence d’une dégradation des protéines cellulaires selon un mécanisme nécessitant l’utilisation d’ATP. Afin de ne pas avoir une vision réductrice de cette voie, ce document fait une présentation assez large des connaissances actuelles sur le sujet, y compris des points sur lesquels demeurent des incertitudes ou des zones d’ombre.
De nos jours, c’est l’un des sujets de recherche les plus actifs en biologie cellulaire. De ce fait, la situation s’est considérablement complexifiée depuis la première mise en évidence de l’existence d’une dégradation des protéines cellulaires selon un mécanisme nécessitant l’utilisation d’ATP. Afin de ne pas avoir une vision réductrice de cette voie, ce document fait une présentation assez large des connaissances actuelles sur le sujet, y compris des points sur lesquels demeurent des incertitudes ou des zones d’ombre.
Présentation générale Le système Ubiquitine-Protéasome (UbPr) est au cœur de la plupart des processus biologiques, comme le cycle cellulaire, l’apoptose, la différenciation musculaire ou encore la réponse immune, notamment du fait de son rôle central dans la dégradation contrôlée des protéines régulatrices de ces processus.
Le système Ubiquitine-Protéasome (UbPr) est au cœur de la plupart des processus biologiques, comme le cycle cellulaire, l’apoptose, la différenciation musculaire ou encore la réponse immune, notamment du fait de son rôle central dans la dégradation contrôlée des protéines régulatrices de ces processus.
Ainsi, le rôle de la protéolyse intracellulaire ne se cantonne pas à éliminer les protéines anormales ou endommagées, mais intervient dans la régulation fine des taux de protéines clés pour la cellule. Au vu de la multitude de substrats et des processus impliqués, il n’est pas surprenant que des dysfonctionnements de ce système soient impliqués dans de nombreuses pathologies, comme les cancers, les maladies neurodégénératives et les maladies auto-immunes. La dégradation d’une protéine via le système UbPr implique généralement deux grandes étapes successives, qui nécessitent toutes deux l’hydrolyse de l’ATP (voir Fig.).
La dégradation d’une protéine via le système UbPr implique généralement deux grandes étapes successives, qui nécessitent toutes deux l’hydrolyse de l’ATP (voir Fig.).
Dans un premier temps, l’ubiquitylation consiste en la conjugaison covalente d’une ou plusieurs molécules d’ubiquitine (Ub), sur un ou plusieurs résidus lysine de la protéine, via une cascade enzymatique impliquant 3 types de facteurs : l’enzyme d’activation de l’ubiquitine (E1), l’enzyme de conjugaison de l’ubiquitine (E2) et l’ubiquitine-ligase (E3). Dans un deuxième temps, le substrat ubiquitylé est ensuite adressé au protéasome 26S où il est dégradé. Le protéasome 26S est un complexe protéolytique d’environ 2 500 kDa formé par l’association du protéasome 20S (le cœur protéolytique de l’enzyme) au complexe régulateur 19S (voir Fig.).
Dans un deuxième temps, le substrat ubiquitylé est ensuite adressé au protéasome 26S où il est dégradé. Le protéasome 26S est un complexe protéolytique d’environ 2 500 kDa formé par l’association du protéasome 20S (le cœur protéolytique de l’enzyme) au complexe régulateur 19S (voir Fig.).
Au cours de cette deuxième étape, le substrat est déubiquitylé, ce qui permet le recyclage de l’ubiquitine, et il est dégradé en peptides qui seront par la suite digérés par des peptidases cytosoliques pour donner des acides-aminés. Ces derniers seront réutilisés soit pour la synthèse de nouvelles protéines, soit pour la production d’énergie pour l’organisme.
Certains peptides générés par le protéasome sont pris en charge par les molécules du complexe majeur d’histocompatibilité (CMH) de classe I, dans le cadre de la présentation des antigènes. Enfin, certaines protéines ne sont que partiellement dégradées par le protéasome qui est donc impliqué dans la maturation protéolytique de précurseurs protéiques (comme le précurseur p105 de la sous-unité p50 du facteur de transcription NFkB ou Nuclear Factor-kappa B).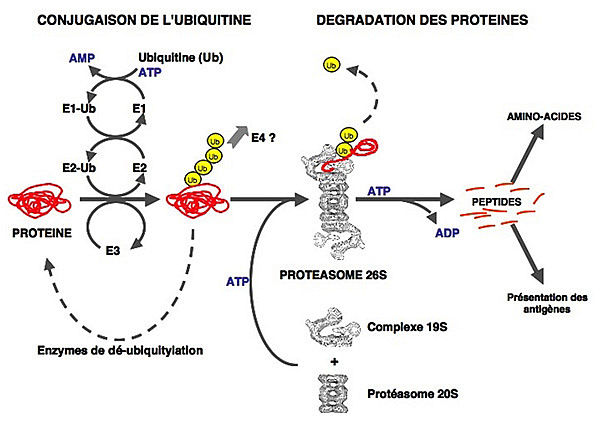 Ce schéma en deux grandes étapes du système ubiquitine-protéasome n’est qu’une vue simplifiée de ce système qui est en fait bien plus complexe. De fait, si certains substrats ne nécessitent pas une ubiquitylation préalable avant d’être dégradés, l’ubiquitylation ne mène pas toujours à la dégradation. Elle est en effet impliquée dans des fonctions indépendantes de la protéolyse comme l’endocytose, l’import nucléaire, ou l’activation de kinases par exemple.
Ce schéma en deux grandes étapes du système ubiquitine-protéasome n’est qu’une vue simplifiée de ce système qui est en fait bien plus complexe. De fait, si certains substrats ne nécessitent pas une ubiquitylation préalable avant d’être dégradés, l’ubiquitylation ne mène pas toujours à la dégradation. Elle est en effet impliquée dans des fonctions indépendantes de la protéolyse comme l’endocytose, l’import nucléaire, ou l’activation de kinases par exemple.
En outre, le protéasome 26S et, plus particulièrement, les sous-unités ATPases du complexe régulateur 19S, sont associées à des fonctions non-protéolytiques.
Par ailleurs, le protéasome 20S peut également être associé à d’autres régulateurs (activateurs ou inhibiteurs) que le complexe 19S, ce qui lui confère des fonctions particulières.
Ces variations autour du modèle général présenté dans la Fig.1 illustrent la complexité du fonctionnement et de la spécificité du système UbPr et expliquent qu’il existe encore un grand nombre de « boîtes noires » dans notre connaissance de ce système.
Irwin Rose (1926-2015) Biochimiste américain qui a reçu une part du prix Nobel de chimie 2004 (avec les Israéliens Aaron Ciechanover et Avram Hershko) pour avoir découvert le rôle de la protéine ubiquitine dans les cellules. Cette petite molécule protéique s’attache à d’autres protéines, les marquant pour les éliminer, qui sont ainsi reconnues par les protéasomes de la cellule. Ces structures sont les unités d’élimination des déchets de la cellule, où les protéines sont décomposées en petits morceaux pour être réutilisées.
Biochimiste américain qui a reçu une part du prix Nobel de chimie 2004 (avec les Israéliens Aaron Ciechanover et Avram Hershko) pour avoir découvert le rôle de la protéine ubiquitine dans les cellules. Cette petite molécule protéique s’attache à d’autres protéines, les marquant pour les éliminer, qui sont ainsi reconnues par les protéasomes de la cellule. Ces structures sont les unités d’élimination des déchets de la cellule, où les protéines sont décomposées en petits morceaux pour être réutilisées. 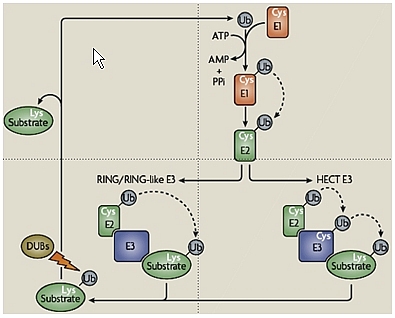 Ce processus médié par l’ubiquitine nettoie les protéines indésirables produites lors de la division cellulaire et effectue un contrôle de qualité sur les protéines nouvellement synthétisées. Des processus défectueux de dégradation des protéines sont à l’origine de maladies telles que la mucoviscidose, plusieurs maladies neurodégénératives et certains types de cancer. »
Ce processus médié par l’ubiquitine nettoie les protéines indésirables produites lors de la division cellulaire et effectue un contrôle de qualité sur les protéines nouvellement synthétisées. Des processus défectueux de dégradation des protéines sont à l’origine de maladies telles que la mucoviscidose, plusieurs maladies neurodégénératives et certains types de cancer. »
https://www.sciencedirect.com/science/article/pii/S0167488904002356
https://www.britannica.com/biography/Irwin-Rose