Prix Nobel de physiologie en 1955 pour ses recherches sur les enzymes d’oxydation
Prix Nobel de physiologie en 1955 pour ses recherches sur les enzymes d’oxydation Hugo Theorell (1903-1982), biochimiste suédois et lauréat du prix Nobel. Son nom complet est Axel Hugo Theodor Theorell.
Hugo Theorell (1903-1982), biochimiste suédois et lauréat du prix Nobel. Son nom complet est Axel Hugo Theodor Theorell. Le biochimiste suédois Hugo Theorell a reçu le prix Nobel de physiologie ou médecine en 1955 pour « ses découvertes concernant la nature et le mode d’action des enzymes d’oxydation ». Il a consacré toute sa carrière à la recherche enzymatique, construisant un long résumé de réalisations scientifiques : Il a été le premier à obtenir la myoglobine cristalline, une protéine qui transporte l’oxygène et se trouve dans le muscle rouge.
Le biochimiste suédois Hugo Theorell a reçu le prix Nobel de physiologie ou médecine en 1955 pour « ses découvertes concernant la nature et le mode d’action des enzymes d’oxydation ». Il a consacré toute sa carrière à la recherche enzymatique, construisant un long résumé de réalisations scientifiques : Il a été le premier à obtenir la myoglobine cristalline, une protéine qui transporte l’oxygène et se trouve dans le muscle rouge. 
 Theorell a découvert que l’enzyme est composée de deux parties : une coenzyme non protéique – le phosphate jaune de riboflavine (vitamine B 2) – et une apoenzyme protéique. Sa découverte (1934) que la coenzyme facilite activement l’oxydation du sucre glucose en liant un atome d’hydrogène à un site spécifique sur la molécule de riboflavine a marqué la première fois que l’effet d’une enzyme a été attribué à l’activité chimique d’atomes spécifiques.
Theorell a découvert que l’enzyme est composée de deux parties : une coenzyme non protéique – le phosphate jaune de riboflavine (vitamine B 2) – et une apoenzyme protéique. Sa découverte (1934) que la coenzyme facilite activement l’oxydation du sucre glucose en liant un atome d’hydrogène à un site spécifique sur la molécule de riboflavine a marqué la première fois que l’effet d’une enzyme a été attribué à l’activité chimique d’atomes spécifiques.
En tant que directeur du département de biochimie de l’Institut médical Nobel de Stockholm (1937-1970), Theorell a étudié l’enzyme oxydative cytochrome c, déterminant la nature précise de la liaison chimique entre la portion de porphyrine non protéique contenant du fer et l’apoenzyme. Son enquête sur l’enzyme de transfert d’hydrogène, l’alcool déshydrogénase, a conduit au développement de tests sanguins sensibles qui ont trouvé une large application dans la détermination des définitions légales de l’intoxication. Outre le prix Nobel, Theorell a reçu de nombreux prix et distinctions. Il a également été président de l’Académie royale suédoise des sciences et de l’Union internationale de biochimie.
Enzyme biochimie
Qu’est-ce qu’une enzyme ? 
 Les enzymes ont également de précieuses applications industrielles et médicales. La fermentation du vin, la levée du pain, le caillage du fromage et le brassage de la bière ont été pratiqués depuis les temps les plus reculés, mais ce n’est qu’au XIXe siècle que ces réactions ont été comprises comme le résultat de l’activité catalytique des enzymes. Depuis lors, les enzymes ont pris une importance croissante dans les procédés industriels impliquant des réactions chimiques organiques. Les utilisations des enzymes en médecine comprennent la destruction des micro-organismes pathogènes, la promotion de la cicatrisation des plaies et le diagnostic de certaines maladies.
Les enzymes ont également de précieuses applications industrielles et médicales. La fermentation du vin, la levée du pain, le caillage du fromage et le brassage de la bière ont été pratiqués depuis les temps les plus reculés, mais ce n’est qu’au XIXe siècle que ces réactions ont été comprises comme le résultat de l’activité catalytique des enzymes. Depuis lors, les enzymes ont pris une importance croissante dans les procédés industriels impliquant des réactions chimiques organiques. Les utilisations des enzymes en médecine comprennent la destruction des micro-organismes pathogènes, la promotion de la cicatrisation des plaies et le diagnostic de certaines maladies.
On pensait autrefois que toutes les enzymes étaient des protéines, mais depuis les années 1980, la capacité catalytique de certains acides nucléiques, appelés ribozymes (ou ARN catalytiques), a été démontrée, réfutant cet axiome. Étant donné que l’on sait encore si peu de choses sur le fonctionnement enzymatique de l’ARN, cette discussion se concentrera principalement sur les enzymes protéiques.
Une grande molécule d’enzyme protéique est composée d’une ou plusieurs chaînes d’acides aminés appelées chaînes polypeptidiques. La séquence d’acides aminés détermine les modèles de repliement caractéristiques de la structure de la protéine, ce qui est essentiel à la spécificité de l’enzyme. Si l’enzyme est soumise à des changements, tels que des fluctuations de température ou de pH, la structure protéique peut perdre son intégrité (dénaturation) et sa capacité enzymatique. La dénaturation est parfois, mais pas toujours, réversible.
 Nomenclature
Nomenclature
Une enzyme interagira avec un seul type de substance ou groupe de substances, appelé le substrat, pour catalyser un certain type de réaction. En raison de cette spécificité, les enzymes ont souvent été nommées en ajoutant le suffixe « -ase » au nom du substrat (comme dans l’uréase, qui catalyse la dégradation de l’urée). Toutes les enzymes n’ont pas été nommées de cette manière, cependant, et pour atténuer la confusion entourant la nomenclature des enzymes, un système de classification a été développé en fonction du type de réaction que l’enzyme catalyse. Il existe six grandes catégories et leurs réactions : les oxydoréductases, qui interviennent dans le transfert d’électrons ; les transférases, qui transfèrent un groupe chimique d’une substance à une autre ; les hydrolases, qui clivent le substrat par absorption d’une molécule d’eau (hydrolyse) ; les lyases, qui forment des doubles liaisons en ajoutant ou en supprimant un groupe chimique ; les isomérases, qui transfèrent un groupe au sein d’une molécule pour former un isomère ; et les ligases, ou synthétases, qui couplent la formation de diverses liaisons chimiques à la rupture d’une liaison pyrophosphate dans l’adénosine triphosphate ou un nucléotide similaire. Mécanisme d’action enzymatique
Mécanisme d’action enzymatique
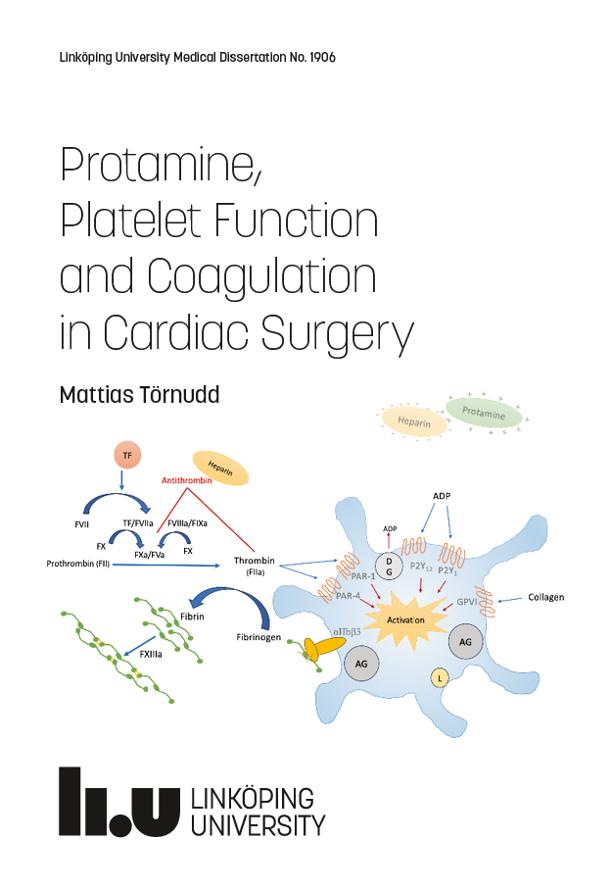
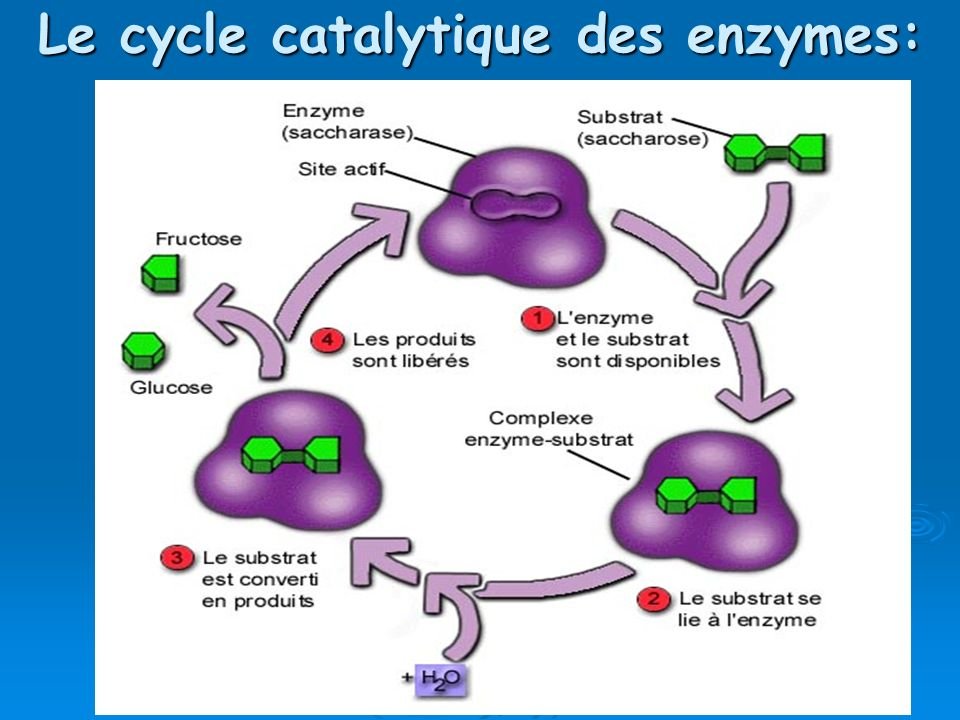
Dans la plupart des réactions chimiques, il existe une barrière énergétique qui doit être surmontée pour que la réaction se produise. Cette barrière empêche les molécules complexes telles que les protéines et les acides nucléiques de se dégrader spontanément, et est donc nécessaire à la préservation de la vie. Cependant, lorsque des changements métaboliques sont nécessaires dans une cellule, certaines de ces molécules complexes doivent être décomposées et cette barrière énergétique doit être surmontée. La chaleur pourrait fournir l’énergie supplémentaire nécessaire (appelée énergie d’activation), mais l’augmentation de la température tuerait la cellule. L’alternative est d’abaisser le niveau d’énergie d’activation grâce à l’utilisation d’un catalyseur. C’est le rôle que jouent les enzymes. Ils réagissent avec le substrat pour former un complexe intermédiaire – un « état de transition » – qui nécessite moins d’énergie pour que la réaction se déroule. Le composé intermédiaire instable se décompose rapidement pour former des produits de réaction, et l’enzyme inchangée est libre de réagir avec d’autres molécules de substrat.

Facteurs affectant l’activité enzymatique
Parce que les enzymes ne sont pas consommées dans les réactions qu’elles catalysent et peuvent être utilisées encore et encore, seule une très petite quantité d’enzyme est nécessaire pour catalyser une réaction. Une molécule d’enzyme typique peut convertir 1 000 molécules de substrat par seconde. La vitesse d’une réaction enzymatique augmente avec l’augmentation de la concentration du substrat, atteignant une vitesse maximale lorsque tous les sites actifs des molécules enzymatiques sont engagés. L’enzyme est alors dite saturée, la vitesse de la réaction étant déterminée par la vitesse à laquelle les sites actifs peuvent convertir le substrat en produit.
L’activité enzymatique peut être inhibée de diverses manières. L’inhibition compétitive se produit lorsque des molécules très similaires aux molécules du substrat se lient au site actif et empêchent la liaison du substrat réel. La pénicilline, par exemple, est un inhibiteur compétitif qui bloque le site actif d’une enzyme que de nombreuses bactéries utilisent pour construire leurs parois cellulaires.
Une inhibition non compétitive se produit lorsqu’un inhibiteur se lie à l’enzyme à un emplacement autre que le site actif. Dans certains cas d’inhibition non compétitive, on pense que l’inhibiteur se lie à l’enzyme de manière à bloquer physiquement le site actif normal. Dans d’autres cas, on pense que la liaison de l’inhibiteur modifie la forme de la molécule d’enzyme, déformant ainsi son site actif et l’empêchant de réagir avec son substrat. Ce dernier type d’inhibition non compétitive est appelé inhibition allostérique ; l’endroit où l’inhibiteur se lie à l’enzyme s’appelle le site allostérique. Fréquemment, un produit final d’une voie métabolique sert d’inhibiteur allostérique sur une enzyme antérieure de la voie. Cette inhibition d’une enzyme par un produit de sa voie est une forme de rétroaction négative.
Le contrôle allostérique peut impliquer une stimulation de l’action enzymatique ainsi qu’une inhibition. Une molécule activatrice peut être liée à un site allostérique et induire une réaction au niveau du site actif en modifiant sa forme pour s’adapter à un substrat qui ne pourrait pas induire le changement par lui-même. Les activateurs courants comprennent les hormones et les produits de réactions enzymatiques antérieures. La stimulation et l’inhibition allostériques permettent la production d’énergie et de matériaux par la cellule lorsqu’ils sont nécessaires et inhibent la production lorsque l’apport est suffisant.
Hugo Theorell
Biochimiste suédois dont l’étude des enzymes qui facilitent les réactions d’oxydation dans les cellules vivantes a contribué à la compréhension de l’action enzymatique et a conduit à la découverte de la manière dont les nutriments sont utilisés par les organismes en présence d’oxygène pour produire de l’énergie utilisable. Theorell a remporté le prix Nobel de physiologie en 1955 pour « pour ses découvertes concernant la nature et le mode d’action des enzymes d’oxydation ».
https://www.sciencephoto.fr/image/11831315-Hugo-Theorell-Swedish-biochemist
https://www.nndb.com/people/669/000129282/