 Le lauréat du prix Nobel William S. Knowles
Le lauréat du prix Nobel William S. Knowles
 William S. Knowles (1917-2012)
William S. Knowles (1917-2012) William S. Knowles , (né le 1er juin 1917 à Taunton , Massachusetts , États-Unis – décédé le 13 juin 2012 à Chesterfield, Missouri), chimiste américain qui, avec Noyori Ryōji et K. Barry Sharpless , a remporté le prix Nobel de chimie en 2001 pour développer les premiers catalyseurs chiraux . Knowles a obtenu un doctorat. de l’Université de Columbia en 1942, après quoi il a mené des recherches à la Monsanto Company à St. Louis, Missouri , jusqu’à sa retraite en 1986.
William S. Knowles , (né le 1er juin 1917 à Taunton , Massachusetts , États-Unis – décédé le 13 juin 2012 à Chesterfield, Missouri), chimiste américain qui, avec Noyori Ryōji et K. Barry Sharpless , a remporté le prix Nobel de chimie en 2001 pour développer les premiers catalyseurs chiraux . Knowles a obtenu un doctorat. de l’Université de Columbia en 1942, après quoi il a mené des recherches à la Monsanto Company à St. Louis, Missouri , jusqu’à sa retraite en 1986. Beaucoup les molécules sont chirales – elles existent sous deux formes structurelles (énantiomères) qui sont des images miroir non superposables. De même, les récepteurs, enzymes et autres composants cellulaires fabriqués à partir de ces molécules sont chiraux et ont tendance à interagir sélectivement avec seulement un ou deux énantiomères d’une substance donnée. Pour de nombreux médicaments, cependant, la synthèse conventionnelle en laboratoire aboutit à un mélange d’énantiomères. Une forme a généralement l’effet désiré tandis que l’autre forme peut être inactive ou provoquer des effets secondaires indésirables, comme cela s’est produit avec le médicament thalidomide . Ce problème a conduit les scientifiques à rechercher des catalyseurs chiraux, qui entraînent des réactions chimiques vers un seul des deux résultats possibles.
Beaucoup les molécules sont chirales – elles existent sous deux formes structurelles (énantiomères) qui sont des images miroir non superposables. De même, les récepteurs, enzymes et autres composants cellulaires fabriqués à partir de ces molécules sont chiraux et ont tendance à interagir sélectivement avec seulement un ou deux énantiomères d’une substance donnée. Pour de nombreux médicaments, cependant, la synthèse conventionnelle en laboratoire aboutit à un mélange d’énantiomères. Une forme a généralement l’effet désiré tandis que l’autre forme peut être inactive ou provoquer des effets secondaires indésirables, comme cela s’est produit avec le médicament thalidomide . Ce problème a conduit les scientifiques à rechercher des catalyseurs chiraux, qui entraînent des réactions chimiques vers un seul des deux résultats possibles. En 1968, Knowles a produit le premier catalyseur chiral pour une réaction d’hydrogénation asymétrique. Il cherchait une synthèse industrielle du médicamentl -dopa , qui est devenue plus tard un pilier du traitement de la maladie de Parkinson . Des variations du nouveau catalyseur ont trouvé une application presque immédiate dans la production de préparations très pures de l’ énantiomère l -dopa souhaité.
En 1968, Knowles a produit le premier catalyseur chiral pour une réaction d’hydrogénation asymétrique. Il cherchait une synthèse industrielle du médicamentl -dopa , qui est devenue plus tard un pilier du traitement de la maladie de Parkinson . Des variations du nouveau catalyseur ont trouvé une application presque immédiate dans la production de préparations très pures de l’ énantiomère l -dopa souhaité.
Biographique William S. Knowles (1917-2012) ; Le prix Nobel de chimie 2001 Je suis né à Taunton, dans le Massachusetts, le 1er juin 1917, mais j’ai en fait grandi dans la ville voisine de New Bedford. Mes antécédents familiaux étaient fortement orientés vers les affaires et les affaires maritimes. Je ne peux penser à aucun membre de ma famille qui soit jamais allé dans la science. Ma famille m’a donné le meilleur de l’éducation. Pour mon père, les affaires étaient la plus haute vocation, mais pour ma mère, la médecine était la première profession. Elle serait probablement allée à l’école de médecine si elle était née à une époque plus éclairée.
Je suis né à Taunton, dans le Massachusetts, le 1er juin 1917, mais j’ai en fait grandi dans la ville voisine de New Bedford. Mes antécédents familiaux étaient fortement orientés vers les affaires et les affaires maritimes. Je ne peux penser à aucun membre de ma famille qui soit jamais allé dans la science. Ma famille m’a donné le meilleur de l’éducation. Pour mon père, les affaires étaient la plus haute vocation, mais pour ma mère, la médecine était la première profession. Elle serait probablement allée à l’école de médecine si elle était née à une époque plus éclairée.
Je suis allé au pensionnat de Berkshire dans l’ouest du Massachusetts, certainement la plus belle partie de l’État. Je n’oublierai jamais les couleurs d’automne sur les Berkshires. À cette époque, j’étais nul en athlétisme et je ne faisais jamais partie d’une équipe, mais je menais assez facilement ma classe à l’université. J’étais particulièrement bon en maths et en sciences. J’ai aussi eu une bonne leçon d’épargne en Nouvelle-Angleterre. Pour avoir de la glace gratuite pour nos expériences de physique, nous avons dû attendre qu’il neige.
Cet été-là, j’ai fait une croisière sur une goélette de 75 pieds sans moteur, naviguant de Gloucester, Massachusetts à la Norvège. Nous avons navigué autour de la Baltique pour finir à Stockholm. Je n’y ai pas pensé à l’époque, mais nous avons passé presque trois semaines dans l’Atlantique Nord sans aucun contact avec le monde extérieur. Aujourd’hui, on est toujours en contact avec sa base même si l’on va au Pôle Sud ou sur la Lune. Les souvenirs de ce voyage à la voile ont toujours été vifs. Dans un cas, nous avons été arrêtés par erreur à Tallin, en Estonie, et nous avons été emmenés dans la paddy wagon. Plus tard, nous avons été relâchés sans commentaire. Je ne pensais pas qu’un jour, des années plus tard, je reviendrais à Stockholm pour partager le prix Nobel de chimie. À Harvard, je me suis spécialisé en chimie avec une forte inclination pour les mathématiques. J’ai pris le minimum de sciences humaines. On m’avait dit que je serais un naturel pour la chimie physique mais prendre le bio avec Louis Fieser m’a fait changer d’avis. C’est là que j’ai eu mon introduction à l’isomérie optique et à l’atome de carbone tétraédrique. À Harvard, la compétition était féroce et j’obtenais toujours un solide B, mais pas les A directs de beaucoup de mes camarades de classe. C’était l’époque où la plupart obtenaient le C d’un gentleman.
À Harvard, je me suis spécialisé en chimie avec une forte inclination pour les mathématiques. J’ai pris le minimum de sciences humaines. On m’avait dit que je serais un naturel pour la chimie physique mais prendre le bio avec Louis Fieser m’a fait changer d’avis. C’est là que j’ai eu mon introduction à l’isomérie optique et à l’atome de carbone tétraédrique. À Harvard, la compétition était féroce et j’obtenais toujours un solide B, mais pas les A directs de beaucoup de mes camarades de classe. C’était l’époque où la plupart obtenaient le C d’un gentleman.
Après avoir obtenu mon diplôme en 1939, on m’a fortement conseillé d’aller ailleurs pour étudier. Je suis allé à Columbia avec le professeur Elderfield et j’ai travaillé sur la fabrication d’analogues simples des aglucones cardiaques. Ceux-ci ont été testés à Eli Lilly pour l’activité cardiaque. Bob Elderfield était à son meilleur lorsqu’il parlait de stéroïdes lorsqu’il était à l’Institut Rockefeller. Parallèlement à l’expérience de Nobel, j’ai moi aussi eu une explosion. Le mien est venu lors de la distillation du diazométhane. Personne n’a été blessé, mais une bouteille d’intermédiaire sur laquelle j’avais travaillé pendant des mois a été détruite. À cette époque, le professeur Elderfield passait beaucoup de temps sur le projet antipaludéen dans l’armée, et nous étions souvent seuls. Le professeur Nelson Leonard, longtemps à l’Université de l’Illinois en Champagne, faisait partie de notre groupe de recherche. Plus tard, il consulta chez Monsanto.
À cette époque, le professeur Elderfield passait beaucoup de temps sur le projet antipaludéen dans l’armée, et nous étions souvent seuls. Le professeur Nelson Leonard, longtemps à l’Université de l’Illinois en Champagne, faisait partie de notre groupe de recherche. Plus tard, il consulta chez Monsanto.
New York était un endroit passionnant pendant ces années de guerre et mon conseil de rédaction a forcé Columbia à me chasser plus tôt que d’habitude. À cette époque, l’industrie engageait n’importe quel chimiste capable de respirer. En 1942, j’ai commencé à Dayton, Ohio dans les laboratoires Thomas et Hochwalt, qui avaient récemment rejoint Monsanto. La plupart de mes missions étaient assez banales, comme la fabrication d’hexaméthylènetétramine super pure à utiliser pour fabriquer la cyclonite explosive. En 1944, j’ai été transféré à Saint-Louis pour travailler sur les plastifiants et les intermédiaires. Nous avons fabriqué beaucoup de benzoate de benzyle comme anti-acariens pour les vêtements des soldats. Plus tard, nous avons eu un projet de DDT qui n’est jamais entré en production avant la fin de la guerre. Plus intéressant, nous avions un processus de synthèse pour la vanilline, mais nous avons perdu la lignine comme moyen d’obtenir cette molécule souhaitable. À cette époque, nous nous sommes impliqués dans la fabrication sur mesure de l’antibiotique chloramphénicol et avons fabriqué 10 à 15 000 livres. avant qu’il ne soit retiré du marché car un très faible pourcentage de patients développait une anémie aplasique. À l’époque, mon chien avait un champignon sur la poitrine qui ne guérissait pas et résistait au traitement. J’ai fait une pommade avec notre produit et ça a disparu en deux jours. Elle a vécu jusqu’à 17 ans.
En 1944, j’ai été transféré à Saint-Louis pour travailler sur les plastifiants et les intermédiaires. Nous avons fabriqué beaucoup de benzoate de benzyle comme anti-acariens pour les vêtements des soldats. Plus tard, nous avons eu un projet de DDT qui n’est jamais entré en production avant la fin de la guerre. Plus intéressant, nous avions un processus de synthèse pour la vanilline, mais nous avons perdu la lignine comme moyen d’obtenir cette molécule souhaitable. À cette époque, nous nous sommes impliqués dans la fabrication sur mesure de l’antibiotique chloramphénicol et avons fabriqué 10 à 15 000 livres. avant qu’il ne soit retiré du marché car un très faible pourcentage de patients développait une anémie aplasique. À l’époque, mon chien avait un champignon sur la poitrine qui ne guérissait pas et résistait au traitement. J’ai fait une pommade avec notre produit et ça a disparu en deux jours. Elle a vécu jusqu’à 17 ans.  Peu de temps après la guerre, la découverte que la cortisone pourrait devenir un produit pharmaceutique à grand volume a poussé Monsanto à engager le professeur Woodward dans l’espoir de commercialiser son approche synthétique. J’ai été sélectionné pour rejoindre cet effort car j’avais une formation en stéroïdes.
Peu de temps après la guerre, la découverte que la cortisone pourrait devenir un produit pharmaceutique à grand volume a poussé Monsanto à engager le professeur Woodward dans l’espoir de commercialiser son approche synthétique. J’ai été sélectionné pour rejoindre cet effort car j’avais une formation en stéroïdes.
En fait, j’ai passé neuf mois dans son laboratoire à Cambridge sur cette synthèse totale. L’expérience de travail avec le « grand homme » est une expérience que je n’oublierai jamais. Pendant les trois premiers mois dans son laboratoire, il arrivait à midi et disait : « Allons à Schrafts. Nous passions une heure ou plus à griffonner des structures chimiques sur le menu ou les sets de table. Sa mémoire phénoménale était au-delà de tout ce que j’avais jamais vu. À cette époque, il ne tenait jamais de dossier ni n’écrivait de référence. Il dirait juste regardez sur la page telle ou telle dans Beilstein et vous trouverez quelque chose à ce sujet. Il a perdu une partie de cette capacité en vieillissant et cela le dérangeait. Il espérait vraiment que Monsanto commercialiserait sa synthèse de stéroïdes, mais l’igname mexicaine avec sa forte teneur en diosgénine a finalement tué nos efforts. Notre programme de cortisone s’est plutôt bien déroulé. Nous avons fait quelques milligrammes de cortisone racémique et nous avions résolu un intermédiaire précoce que nous avions l’intention de mener à bien. Il a été rendu trop complexe pour rivaliser avec l’igname modeste. Plus tard dans les années 50, je me suis impliqué dans des études cinétiques en utilisant ma formation en mathématiques oubliée depuis longtemps. Ces études ont permis d’améliorer plusieurs de nos procédés en doublant la production avec peu ou pas de capital supplémentaire. À cette époque, l’industrie était avide de produits chimiques et beaucoup d’efforts étaient déployés pour obtenir plus dans le même équipement.
Plus tard dans les années 50, je me suis impliqué dans des études cinétiques en utilisant ma formation en mathématiques oubliée depuis longtemps. Ces études ont permis d’améliorer plusieurs de nos procédés en doublant la production avec peu ou pas de capital supplémentaire. À cette époque, l’industrie était avide de produits chimiques et beaucoup d’efforts étaient déployés pour obtenir plus dans le même équipement.
Monsanto avait développé une ligne d’avancement distincte pour ceux qui souhaitaient rester dans la technologie et j’ai atteint le sommet de cette échelle avant même d’avoir pensé aux hydrogénations asymétriques. J’étais quelqu’un qui aimait travailler aussi bien avec ses mains qu’avec son cerveau. La recherche chimique en laboratoire était idéale pour combler ce besoin. Le travail sur le projet asymétrique, qui a commencé au milieu des années soixante, est le sujet de ma conférence. Évidemment, je suis resté actif dans ce domaine jusqu’à ma retraite en 1986, et j’ai continué en tant que consultant pendant plusieurs années par la suite. Sur le front intérieur, nous avions acheté une cabane à Jackson Hole, Wyoming il y a 25 ans et nous y avons passé des étés et quelques hivers à skier depuis. C’est là que se retrouvent souvent nos quatre enfants et quatre petits-enfants. A plusieurs reprises, le professeur Kagan nous y a rendu visite et nous avons pu parler d’hydrogénations asymétriques. J’ai toujours aimé faire des choses à l’extérieur, y compris la pêche à la mouche, la randonnée et le vélo. Quand les choses tournent mal, je trouve que fendre du bois est très thérapeutique. J’ai reçu plusieurs récompenses pour notre travail.
Sur le front intérieur, nous avions acheté une cabane à Jackson Hole, Wyoming il y a 25 ans et nous y avons passé des étés et quelques hivers à skier depuis. C’est là que se retrouvent souvent nos quatre enfants et quatre petits-enfants. A plusieurs reprises, le professeur Kagan nous y a rendu visite et nous avons pu parler d’hydrogénations asymétriques. J’ai toujours aimé faire des choses à l’extérieur, y compris la pêche à la mouche, la randonnée et le vélo. Quand les choses tournent mal, je trouve que fendre du bois est très thérapeutique. J’ai reçu plusieurs récompenses pour notre travail.
1974 Prix IR 100 pour l’hydrogénation asymétrique
1978 Prix de la section ACS de St. Louis
1981 Prix Monsanto Thomas et Hochwalt
1982 Prix ACS de l’invention créative
1996 The Organic Reactions Catalysis Society – Prix Paul N. Rylander
Motivation du prix : «pour leurs travaux sur les réactions d’hydrogénation catalysées par la chiralité»
 Le lauréat du prix Nobel William S. Knowles
Le lauréat du prix Nobel William S. Knowles Nécrologie : un chimiste chercheur a été le pionnier du domaine de la catalyse asymétrique
Nécrologie : un chimiste chercheur a été le pionnier du domaine de la catalyse asymétrique William S. Knowles, 95 ans, un chimiste senior à la retraite de Monsanto qui a partagé le prix Nobel de chimie en 2001 pour son travail de pionnier en catalyse asymétrique, est décédé le 13 juin à Chesterfield, Mo., des complications de la maladie de Lou Gehrig.
William S. Knowles, 95 ans, un chimiste senior à la retraite de Monsanto qui a partagé le prix Nobel de chimie en 2001 pour son travail de pionnier en catalyse asymétrique, est décédé le 13 juin à Chesterfield, Mo., des complications de la maladie de Lou Gehrig.
À la fin des années 1960, Knowles a travaillé pour développer un catalyseur qui pourrait être utilisé pour synthétiser directement des énantiomères individuels de composés chiraux, sans avoir à les séparer des mélanges racémiques. Par la suite, il a dirigé une équipe de chercheurs qui ont développé des ligands phosphines chiraux qui se sont avérés efficaces dans la synthèse énantiosélective de l’acide aminé l-dopa, utilisé pour traiter la maladie de Parkinson. Il a pris sa retraite en 1986 après 44 ans chez Monsanto.
Knowles a partagé la moitié du prix Nobel avec Ryoji Noyori de l’Université de Nagoya, au Japon, pour leurs travaux sur les réactions d’hydrogénation catalysées par la chiralité. L’autre moitié du prix est allée à K. Barry Sharpless du Scripps Research Institute pour ses travaux sur les réactions d’oxydation catalysées par la chiralité.
Né à Taunton, Mass., Knowles a obtenu un BS en chimie de l’Université de Harvard en 1939 et un doctorat. en chimie de l’Université de Columbia en 1942 sous la direction de Robert C. Elderfield.
Knowles est devenu membre de l’American Chemical Society en 1940. Il a embrassé les causes environnementales et aimait la pêche à la mouche, la randonnée et le vélo.
Knowles laisse dans le deuil sa femme de 66 ans, Nancy; trois filles, Lesley McIntire, Elizabeth et Sarah; un fils, Pierre; et quatre petits-enfants.
En remportant le prix Nobel, « je ne m’attendais pas vraiment à ce que cela m’arrive… mais cela l’a probablement rendu doublement agréable. »
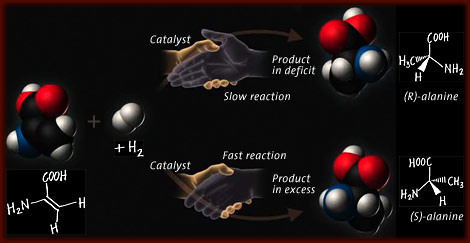
Pour chaque main gauche, il y a une main droite correspondante, et pour chaque isomère l , un isomère d . Ainsi va la règle de l’image miroir de la chiralité. La plupart des molécules dans la nature existent dans l’un ou l’autre des deux énantiomères chiraux, des formes qui se reflètent mutuellement dans la structure. En chimie, les molécules chirales sont importantes car un énantiomère d’un composé donné peut être biologiquement actif, alors que son énantiomère à image miroir est inactif. Par exemple, l’alanine, un acide aminé commun, a deux formes chirales, la S -alanine et la R -alanine, mais seule la S -alanine est répandue dans les protéines.
L’enrichissement des seules formes chirales bioactives d’un composé est une préoccupation majeure des chimistes depuis des décennies, et William S. Knowles est l’un des pionniers fondateurs du domaine de la chimie chirale. Retraité après plus de 40 ans chez Monsanto (St. Louis, MO), Knowles a été élu à l’Académie nationale des sciences (NAS) en 2004. Avec Ryoji Noyori et K. Barry Sharpless, Knowles a reçu le prix Nobel de chimie en 2001 pour sa vie de travail de pionnier dans la synthèse catalytique asymétrique, en particulier dans le domaine de l’hydrogénation ( 1 , 2 ). La synthèse asymétrique catalytique est un processus de type enzyme qui peut produire rapidement un excès d’une forme de composé chiral, un processus avec de nombreuses applications pratiques, telles que la production de biomatériaux industriels et de produits pharmaceutiques.
Bien qu’admis à l’Université de Harvard (Cambridge, MA) à 17 ans, Knowles s’est vu déconseiller d’y aller à ce moment-là parce qu’il était «trop jeune socialement pour aller à l’université». Ainsi, il a passé une deuxième année de terminale dans un autre internat, Phillips Academy Andover (Andover, MA). À Andover, Knowles a suivi son premier cours de chimie, enseigné par Bushy Graham, et est devenu « fasciné par le sujet ». Dit Knowles, « Je me souviens [Graham] essayant d’expliquer le numéro d’Avogadro et sa discussion sur les dangers de l’hydrogène et de l’oxygène. » À la fin de l’année à Andover, Knowles a participé à un concours et a remporté son premier prix académique, un prix Boylston de 50 $ en chimie. Knowles est entré à Harvard l’année suivante, se spécialisant en chimie avec un accent sur les mathématiques. « Celui qui m’a amené à la chimie en premier lieu était Louis Fieser à Harvard », explique Knowles, qui s’est intéressé à la chimie organique dans l’une des classes de Fieser. « Je me dirigeais vers … la chimie physique à cause de mon penchant pour les mathématiques, mais [Fieser] m’a orienté dans une autre direction. » À partir de ce moment, la chimie organique est devenue la passion de recherche de Knowles.
Knowles est entré à Harvard l’année suivante, se spécialisant en chimie avec un accent sur les mathématiques. « Celui qui m’a amené à la chimie en premier lieu était Louis Fieser à Harvard », explique Knowles, qui s’est intéressé à la chimie organique dans l’une des classes de Fieser. « Je me dirigeais vers … la chimie physique à cause de mon penchant pour les mathématiques, mais [Fieser] m’a orienté dans une autre direction. » À partir de ce moment, la chimie organique est devenue la passion de recherche de Knowles.
Rédigé dans l’industrie : Après avoir obtenu son AB à Harvard en 1939, Knowles a commencé des études doctorales à l’Université de Columbia (New York) sous la direction de Robert Elderfield. La thèse de doctorat de Knowles portait sur la synthèse d’analogues simples d’aglycones cardiaques et le test de leur activité cardiaque. « J’étais en quelque sorte un chimiste des stéroïdes », dit-il. Doctorat de Knowles. thèse portant sur la synthèse d’analogues de la digitaline (digoxine), un médicament utilisé en thérapie cardiovasculaire. Il obtient son doctorat en chimie organique de synthèse en 1942. La carrière universitaire de Knowles en tant que chimiste organique synthétique a cependant été de courte durée et une carrière professionnelle a pris sa place au début de la Seconde Guerre mondiale et les scientifiques ont été utilisés par le gouvernement. « New York était un endroit passionnant pendant ces années de guerre, [mais] mon conseil de rédaction a forcé Columbia à me chasser plus tôt » que d’habitude, se souvient Knowles. « À cette époque, l’industrie engageait n’importe quel chimiste capable de respirer. » Ainsi, en 1942, Knowles a commencé à travailler dans les laboratoires Thomas et Hochwalt, qui font partie de Monsanto, à Dayton, OH. Il a décrit son travail à cette époque comme « assez banal » car il effectuait des tâches chimiques telles que la synthèse d’hexaméthylènetétramine pure pour fabriquer la cyclonite explosive.
La carrière universitaire de Knowles en tant que chimiste organique synthétique a cependant été de courte durée et une carrière professionnelle a pris sa place au début de la Seconde Guerre mondiale et les scientifiques ont été utilisés par le gouvernement. « New York était un endroit passionnant pendant ces années de guerre, [mais] mon conseil de rédaction a forcé Columbia à me chasser plus tôt » que d’habitude, se souvient Knowles. « À cette époque, l’industrie engageait n’importe quel chimiste capable de respirer. » Ainsi, en 1942, Knowles a commencé à travailler dans les laboratoires Thomas et Hochwalt, qui font partie de Monsanto, à Dayton, OH. Il a décrit son travail à cette époque comme « assez banal » car il effectuait des tâches chimiques telles que la synthèse d’hexaméthylènetétramine pure pour fabriquer la cyclonite explosive.
Knowles a été transféré en 1944 à Monsanto à Saint-Louis pour travailler sur les plastifiants et les intermédiaires. Il a travaillé sur une variété de projets au cours des années suivantes, y compris la fabrication de benzoate de benzyle comme répulsif contre les acariens pour les vêtements des soldats ; la production de dichloro-diphényl-trichloroéthane (DDT), qui a commencé sérieusement après la guerre ; et la synthèse de la vanilline, qui a été abandonnée après la découverte de la lignine comme moyen de produire cette saveur. Le travail avec la vanilline chez Monsanto a finalement conduit à la production commerciale de l’acide aminé l -3,4-dihydroxyphénylalanine ( l -DOPA), qui est utilisé pour traiter la maladie de Parkinson.
Il est retourné à Harvard en 1951 pour un séjour post-doctoral de 9 mois parrainé par l’entreprise avec Woodward. « L’expérience de travail avec le ‘grand homme’ est une expérience que je n’oublierai jamais », déclare Knowles dans son autobiographie Nobel. « Nous passions une heure ou plus à griffonner des structures chimiques sur le menu ou les sets de table. Sa mémoire phénoménale était au-delà de tout ce que j’avais jamais vu. Knowles a continué à étudier la synthèse totale de la cortisone, ainsi que ses intermédiaires bicycliques actifs, tout au long des années 1950 . « Rien n’est venu de l’effort » pour commercialiser la synthèse totale de stéroïdes de Woodward, dit Knowles, « mais cela m’a laissé un intérêt pour la chimie des stéroïdes en tant qu’observateur inactif. »

De nos jours, cependant, des taux de rendements décroissants peuvent être observés dans les industries biochimiques. Par exemple, les sociétés pharmaceutiques et biotechnologiques continuent de dépenser des milliards de dollars pour la recherche et le développement de nouveaux composés thérapeutiques, mais seule une minorité des produits pharmaceutiques résultants compense ces coûts. « Je suppose que cela se passe dans les produits pharmaceutiques », dit Knowles. « Ils obtiennent un grand coup de pouce maintenant, mais finalement, il sera de plus en plus difficile de trouver des médicaments à succès. Je ne sais pas où ils iront à partir de là.
A cette époque, si des composés chiraux étaient nécessaires, ils étaient obtenus soit par des méthodes biochimiques, soit à partir de mélanges racémiques suivis d’étapes de résolution laborieuses et coûteuses. Knowles a découvert que bien que des mélanges racémiques d’acides aminés sans l’ isomère d indésirable puissent être facilement fabriqués, les coûts et la complexité de ces techniques étaient élevés et ne pouvaient pas rivaliser avec les processus biochimiques, où l’ isomère l souhaité pouvait être obtenu directement.
 Deux résultats de recherche au milieu des années 1960 ont fait croire à Knowles qu’un tel catalyseur serait réalisable. Tout d’abord, le groupe de G. Wilkinson a découvert le chlorotris ( triphénylphosphine)rhodium [RhCl(PPh 3 ) 3 ], qui pourrait agir comme un catalyseur d’hydrogénation soluble pour les oléfines non encombrées à des taux comparables à leurs homologues hétérogènes bien connus. Deuxièmement, Horner et Mislow ont rapporté séparément des méthodes de préparation de phosphines optiquement actives.
Deux résultats de recherche au milieu des années 1960 ont fait croire à Knowles qu’un tel catalyseur serait réalisable. Tout d’abord, le groupe de G. Wilkinson a découvert le chlorotris ( triphénylphosphine)rhodium [RhCl(PPh 3 ) 3 ], qui pourrait agir comme un catalyseur d’hydrogénation soluble pour les oléfines non encombrées à des taux comparables à leurs homologues hétérogènes bien connus. Deuxièmement, Horner et Mislow ont rapporté séparément des méthodes de préparation de phosphines optiquement actives.
 Chimie industrielle : Juste au moment où Knowles et son groupe ont découvert le CAMP, un autre développement apparemment sans rapport allait bientôt avoir un impact sur ses recherches : la découverte que la l -DOPA était utile dans le traitement de la maladie de Parkinson. Cette découverte a créé une demande soudaine pour cet acide aminé rare. De plus, à l’insu de Knowles, Monsanto fabriquait déjà sur mesure un intermédiaire racémique à partir de vanilline, que Hoffman-Laroche résolvait et débloquait en l -DOPA. Le procédé, qui utilisait la synthèse Erlenmeyer Az-lactone, impliquait une étape d’hydrogénation avec un catalyseur symétrique. En principe, tout ce qui était nécessaire pour fabriquer de la l -DOPA directement sans résolution laborieuse était de remplacer le catalyseur symétrique par le nouveau catalyseur asymétrique.
Chimie industrielle : Juste au moment où Knowles et son groupe ont découvert le CAMP, un autre développement apparemment sans rapport allait bientôt avoir un impact sur ses recherches : la découverte que la l -DOPA était utile dans le traitement de la maladie de Parkinson. Cette découverte a créé une demande soudaine pour cet acide aminé rare. De plus, à l’insu de Knowles, Monsanto fabriquait déjà sur mesure un intermédiaire racémique à partir de vanilline, que Hoffman-Laroche résolvait et débloquait en l -DOPA. Le procédé, qui utilisait la synthèse Erlenmeyer Az-lactone, impliquait une étape d’hydrogénation avec un catalyseur symétrique. En principe, tout ce qui était nécessaire pour fabriquer de la l -DOPA directement sans résolution laborieuse était de remplacer le catalyseur symétrique par le nouveau catalyseur asymétrique.
 Nobel surprise : Les recherches de Knowles sur la synthèse asymétrique catalytique ont duré des années 1970 et 1980 et, en 1986, il a pris sa retraite de Monsanto et a occupé un poste de consultant pendant 5 ans supplémentaires. « J’ai toujours été intéressé à trouver des moyens plus efficaces de fabriquer des produits chimiques », dit-il. Quinze ans après sa retraite, le comité du prix Nobel a reconnu ce sentiment en décernant à Knowles le prix Nobel de chimie. La moitié du prix a été partagée par Knowles et Ryoji Noyori, l’autre moitié étant attribuée à Barry Sharpless.
Nobel surprise : Les recherches de Knowles sur la synthèse asymétrique catalytique ont duré des années 1970 et 1980 et, en 1986, il a pris sa retraite de Monsanto et a occupé un poste de consultant pendant 5 ans supplémentaires. « J’ai toujours été intéressé à trouver des moyens plus efficaces de fabriquer des produits chimiques », dit-il. Quinze ans après sa retraite, le comité du prix Nobel a reconnu ce sentiment en décernant à Knowles le prix Nobel de chimie. La moitié du prix a été partagée par Knowles et Ryoji Noyori, l’autre moitié étant attribuée à Barry Sharpless.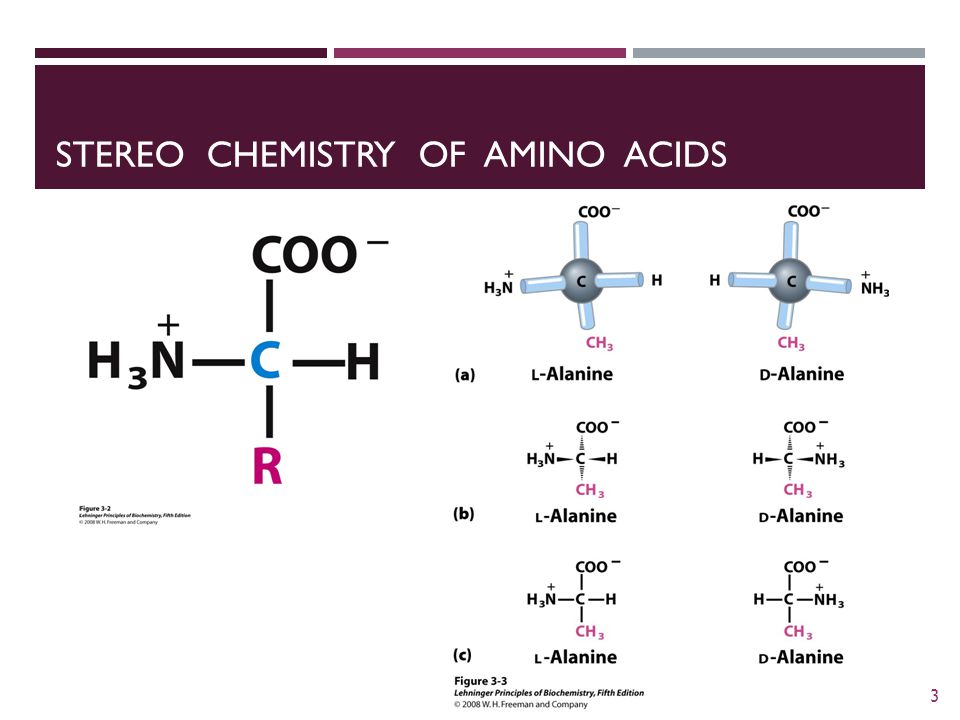 « Knowles a tout fait », déclare Sharpless, professeur de chimie WM Keck au Scripps Research Institute (La Jolla, Californie) et membre du NAS élu en 1985. « Bill Knowles nous a montré que nous pouvions le faire, et le reste d’entre nous est venu le long et l’a fait », dit-il à propos des réactions asymétriques catalytiques. Alors que Knowles et Noyori ont reçu leur part du prix Nobel pour leurs travaux sur les réactions d’hydrogénation catalysées chiralement, Sharpless a reçu sa part de prix pour la recherche sur les réactions d’oxygénation catalysées chiralement. Paraphrasant le chimiste estimé et membre du NAS Jack Halpern de l’Université de Chicago, qui a également apporté des connaissances majeures en hydrogénation catalytique, Sharpless déclare : « Le monopole que la nature avait sur ce genre d’astuce a été brisé. Grâce au travail de Knowles et d’autres, des processus artificiels spécifiques et efficaces étaient désormais possibles.
« Knowles a tout fait », déclare Sharpless, professeur de chimie WM Keck au Scripps Research Institute (La Jolla, Californie) et membre du NAS élu en 1985. « Bill Knowles nous a montré que nous pouvions le faire, et le reste d’entre nous est venu le long et l’a fait », dit-il à propos des réactions asymétriques catalytiques. Alors que Knowles et Noyori ont reçu leur part du prix Nobel pour leurs travaux sur les réactions d’hydrogénation catalysées chiralement, Sharpless a reçu sa part de prix pour la recherche sur les réactions d’oxygénation catalysées chiralement. Paraphrasant le chimiste estimé et membre du NAS Jack Halpern de l’Université de Chicago, qui a également apporté des connaissances majeures en hydrogénation catalytique, Sharpless déclare : « Le monopole que la nature avait sur ce genre d’astuce a été brisé. Grâce au travail de Knowles et d’autres, des processus artificiels spécifiques et efficaces étaient désormais possibles. « Cette réalisation a convaincu la communauté universitaire/industrielle de la puissance de la synthèse chimique asymétrique », déclare Noyori, professeur de chimie à l’Université de Nagoya (Nagoya, Japon) et président du RIKEN (Institut de recherche physique et chimique ; Saitama, Japon). Associé étranger du NAS élu en 2003, Noyori explique qu’une foule de composés chiraux biologiques importants sont désormais accessibles par des moyens purement chimiques. Knowles « a démontré l’importance de la recherche fondamentale en étant le pionnier de l’hydrogénation asymétrique homogène », dit-il.
« Cette réalisation a convaincu la communauté universitaire/industrielle de la puissance de la synthèse chimique asymétrique », déclare Noyori, professeur de chimie à l’Université de Nagoya (Nagoya, Japon) et président du RIKEN (Institut de recherche physique et chimique ; Saitama, Japon). Associé étranger du NAS élu en 2003, Noyori explique qu’une foule de composés chiraux biologiques importants sont désormais accessibles par des moyens purement chimiques. Knowles « a démontré l’importance de la recherche fondamentale en étant le pionnier de l’hydrogénation asymétrique homogène », dit-il.
« Ce que je trouve si cool chez Knowles, c’est qu’il est un tel gentleman », déclare Sharpless, « et il est sorti de nulle part, en fait. Il a été surpris, je pense, de remporter le prix Nobel. Knowles est d’accord. « C’est sorti de nulle part pour moi », dit-il. « Je ne m’attendais pas vraiment à ce que cela m’arrive… mais cela l’a probablement rendu doublement agréable. » Un indice que Knowles a reçu qu’il pourrait gagner le prix Nobel est venu au printemps 2001, lorsqu’il a reçu un appel du chimiste organique Per Ahlberg en Suède. Ahlberg a prétendu écrire un article de synthèse sur le domaine de Knowles pour une publication locale. Il a promis d’envoyer à Knowles une réimpression. En fait, cependant, cet « article de synthèse » s’est avéré être une information pour le comité Nobel. Après avoir remporté le prix, Knowles se souvient d’Ahlberg en disant : « J’espère que vous n’allez pas attendre cette réimpression ! » Muses Knowles, « Son travail était, je pense, d’établir plus ou moins que j’étais vivant et actif. »
Un indice que Knowles a reçu qu’il pourrait gagner le prix Nobel est venu au printemps 2001, lorsqu’il a reçu un appel du chimiste organique Per Ahlberg en Suède. Ahlberg a prétendu écrire un article de synthèse sur le domaine de Knowles pour une publication locale. Il a promis d’envoyer à Knowles une réimpression. En fait, cependant, cet « article de synthèse » s’est avéré être une information pour le comité Nobel. Après avoir remporté le prix, Knowles se souvient d’Ahlberg en disant : « J’espère que vous n’allez pas attendre cette réimpression ! » Muses Knowles, « Son travail était, je pense, d’établir plus ou moins que j’étais vivant et actif. »
Knowles souligne spécifiquement qu’un quatrième chercheur en chimie, Henri Kagan, mérite d’être reconnu pour ses contributions au domaine de la synthèse asymétrique catalytique. Professeur émérite de l’Université Paris-Sud (Université Paris-Sud, Orsay, France) et fondateur du Laboratoire de Synthèse Asymétrique de l’université (Laboratoire de Synthèse Asymétrique, Orsay, France), Kagan a fait des découvertes similaires en synthèse asymétrique environ 6 mois après Knowles. Bien que, d’une certaine manière, « Kagan ait été exclu de l’acte », dit Knowles, il souligne que Kagan a reçu le prix Wolf de chimie en janvier 2001, aux côtés de Noyori et Sharpless. Décerné par la Wolf Foundation en Israël, le prix Wolf est souvent considéré comme le prix le plus prestigieux en chimie après le Nobel. Quant à la raison pour laquelle il a été choisi pour recevoir le prix Nobel, Knowles pense que c’est parce qu’il a créé une « invention » immédiatement applicable avec son procédé de production de synthèse chirale à grande échelle pour la l -DOPA. « C’était la différence », dit-il. Selon Knowles, ce qui a impressionné le comité Nobel avait probablement plus à voir avec l’invention de quelque chose immédiatement applicable et avec la pertinence des sciences de la vie, malgré le fait qu’ils ne décernent généralement pas de prix à l’industrie. « Ce n’était pas une curiosité de laboratoire », dit-il, soulignant que la technique a été utilisée dans les 6 mois pour établir un processus de production de 50 gallons. « C’était inhabituellement rapide pour une toute nouvelle invention », et c’est ce qui a attiré l’attention de l’académie suédoise, selon Knowles.
Quant à la raison pour laquelle il a été choisi pour recevoir le prix Nobel, Knowles pense que c’est parce qu’il a créé une « invention » immédiatement applicable avec son procédé de production de synthèse chirale à grande échelle pour la l -DOPA. « C’était la différence », dit-il. Selon Knowles, ce qui a impressionné le comité Nobel avait probablement plus à voir avec l’invention de quelque chose immédiatement applicable et avec la pertinence des sciences de la vie, malgré le fait qu’ils ne décernent généralement pas de prix à l’industrie. « Ce n’était pas une curiosité de laboratoire », dit-il, soulignant que la technique a été utilisée dans les 6 mois pour établir un processus de production de 50 gallons. « C’était inhabituellement rapide pour une toute nouvelle invention », et c’est ce qui a attiré l’attention de l’académie suédoise, selon Knowles.
Chimie verte : Bien à la retraite, Knowles réfléchit à l’avenir de la chimie. En regardant vers l’avant, il prévoit que son domaine entrera dans le domaine de la « chimie verte ». La chimie verte vise à rendre les produits chimiques industriels et biologiques plus sûrs pour l’environnement et le public avec beaucoup moins de sous-produits. Pour atteindre cet objectif de production chimique moins coûteuse, la synthèse chirale catalytique jouera probablement un rôle essentiel. « La chimie verte copie vraiment un peu la nature », déclare Knowles. « Cela va nécessiter principalement de la chimie catalytique pour faire cela. Nous devons avoir de meilleurs catalyseurs. Trouver des moyens de rivaliser avec la nature a guidé une grande partie de la carrière de recherche de Knowles. « Il se trouve que nous avons trouvé un moyen » avec la synthèse catalytique asymétrique « et c’est pourquoi nous avons obtenu une certaine reconnaissance », dit-il. « Le problème avec les catalyseurs de la nature est… vous n’avez aucune polyvalence. C’est très spécifique pour ce que la nature l’a conçu pour faire. C’est tout ce qu’il fait. Pour en revenir aux paroles de Halpern, cependant, les réalisations catalytiques chirales de Knowles « ont brisé le monopole de la nature » et ont en effet trouvé un moyen de surpasser la nature. Malgré ces réalisations, dit Knowles, « la nature est toujours le meilleur chimiste ».
Trouver des moyens de rivaliser avec la nature a guidé une grande partie de la carrière de recherche de Knowles. « Il se trouve que nous avons trouvé un moyen » avec la synthèse catalytique asymétrique « et c’est pourquoi nous avons obtenu une certaine reconnaissance », dit-il. « Le problème avec les catalyseurs de la nature est… vous n’avez aucune polyvalence. C’est très spécifique pour ce que la nature l’a conçu pour faire. C’est tout ce qu’il fait. Pour en revenir aux paroles de Halpern, cependant, les réalisations catalytiques chirales de Knowles « ont brisé le monopole de la nature » et ont en effet trouvé un moyen de surpasser la nature. Malgré ces réalisations, dit Knowles, « la nature est toujours le meilleur chimiste ». 
https://cen.acs.org/articles/90/web/2012/06/Nobel-Laureate-William-S-Knowles.html
https://www.nobelprize.org/prizes/chemistry/2001/knowles/facts/